Complexation
Définition: Association (M-L)
M et L non identifiés par des réactions caractéristiques. Leurs propriétés analytiques sont dissimulées.
Donneur de particule
\begin{align} {ML} &\rightleftharpoons {M} + :{L}\\ {\underset{\text{Donneur}}{M_mL_n} & <=> \underset{\text{Accepteur}}{mM} +\underset{\text{Particule}}{nL} } \end{align}
- Mononucléaire
- Polynucléaire
- Ligands = Coordinats
- Indice de coordinance: L M
- Structure (gaz inertes)
Différents types de Complèxes
- Simples : ex: {Cu(H_2O)_2^{2+}} ; {Ag(CN)_2^-} ; {Hg(CN)20}
- Chélates : ex: {Cu^{2+}} + 2 {{ }_2HN-CH_2-CH_2-NH_2} (éthylène diamine, ac. Aminés (zwitterionique+-), dipyridine {(C_4H_4N)_2}
Autres chélateurs:
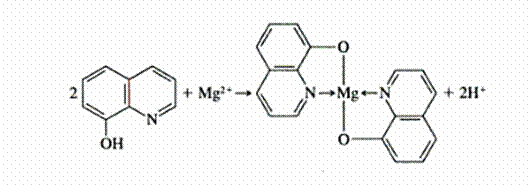
- Hydroxy8quinoléine (Mg du Sang; Al de l’eau pour hémodialyse)
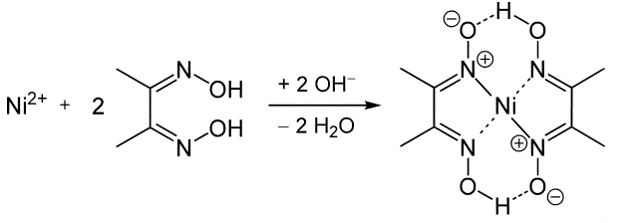
- Diméthylglyoxine (Ni)
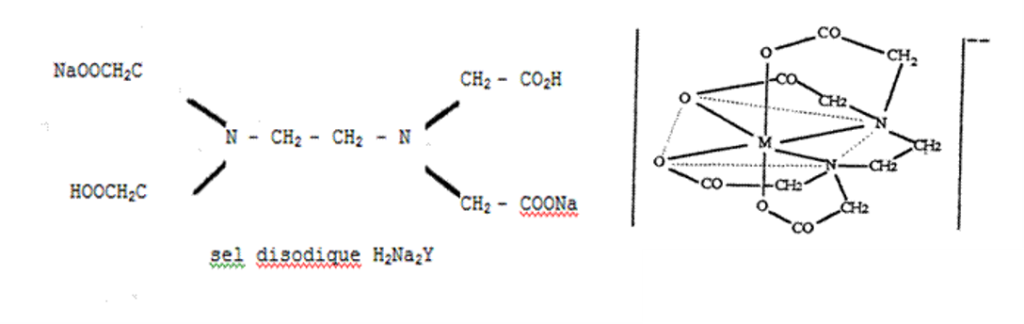
- EDTA (Ca, Mg, Fe…)
- Glyoxal (Ca); Thiourée (Bi); Phénanthroline ( {Fe^{2+}} ); Indicateurs (NET…)
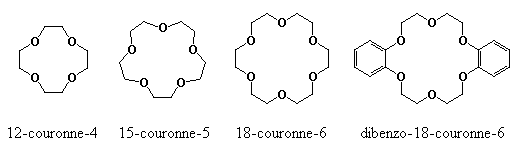
- Éther couronne (piégeage sélectif des ions légers) (Voir Pharmacopée)
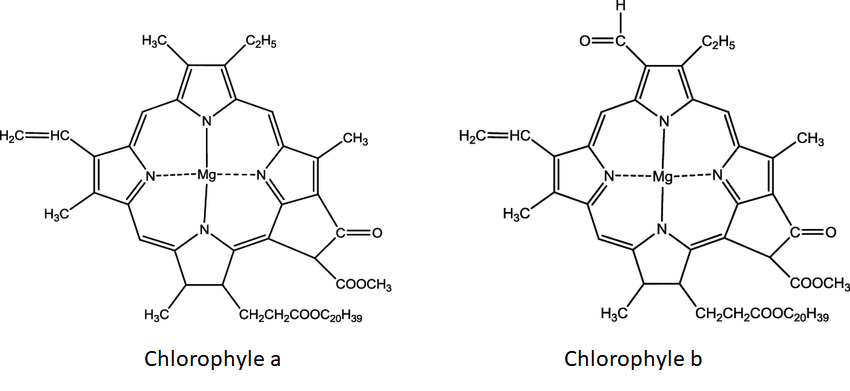
NB: Chélates naturels: Chlorophylles ( {Mg^{2+}} ); hémoglobines ( {Fe^{2+}} )
Ex. de formation de Complexes:
Complexe M- EDTA :
Éthers couronnes : Li, Na, K :
Chlorophylles : sont constituées d’un noyau tétrapyrrolique avec un magnésium en son centre, et estérifié avec un alcool à très longue chaine en C20 (le phytol).
Aspects qualitatifs
- Complexe parfait : pas de dissociation ex: {Fe(CN)_6^{3-}} = (Ferricyanure) , {Fe(CN)_6^{4-}} = (Ferrocyanure)
- Complexe imparfait : dissociation partielle. ex: {HgI_4^{2-} + H_2O \longrightarrow HgI_2 + 2I^-}
Aspects quantitatifs: (constante de stabilité)
un complexe est toujours partiellement dissocié:
- Constante de stabilité \beta ; K_S; K_F
- Constante de dissociation: K_C; K_D
Exemple:
\begin{align} {M_mL_n &\rightleftharpoons mM + nL}\\ \beta ou K_S &= \dfrac{[M_mL_n]}{[M]^m[L]^n}\\ K_C \text{ ou } K_D &= \dfrac{[M]^m[L]^n}{[M_mL_n ]}\\ K_S &= \dfrac{1}{K_D}\\ pK_D &= -\log K_D = \log K_S \end{align}
K évalue la force des complexes
- Plus [/latex]pK_D[/latex] grand: plus l’accepteur est fort donc le complexe est stable.
- Plus [/latex]pK_S[/latex] petit: plus le complexe est stable.
Complexes successifs
\begin{align} {M + nL \rightleftharpoons ML_n} \end{align}
Si n supérieur à 1, addition successive de L:
\begin{align}
{Hg^{2+} + Cl^- &\rightleftharpoons HgCl^+} \qquad \beta_1 (\text{constante partielle})\\
{HgCl^+ + Cl^- &\rightleftharpoons HgCl_2} \qquad \beta_2\\
{HgCl_2 + Cl^- &\rightleftharpoons HgCl_3^-} \qquad \beta_3\\
{HgCl_3^- + Cl^- &\rightleftharpoons HgCl_4^{2-}} \qquad \beta_4
\end{align}
\begin{align}
{Hg^{2+} + 4Cl^- \rightleftharpoons HgCl_4^{2-}} \qquad K(\text{cte globale})
\end{align}
\begin{align}
\beta_1 = \qquad ; \beta_2 = \cdots \qquad ; \beta_n = \\
K(globale) = \beta_1 \cdot \beta_2 \cdot \beta_3 \cdot \beta_4 = \prod K_i = \prod \beta_i
\end{align}
\begin{align}
pK_D=\sum_{i=1}^{n}pK_i
\end{align}
Réactions secondaires
exemple:
\begin{align}
{AgCl +2NH_3 \rightleftharpoons Ag(NH_3)_2 + Cl^-}
\end{align}
On acidifie:
\begin{align}
{Ag(NH_3)_2 +2HCl \rightleftharpoons AgCl + 2NH_4Cl}
\end{align}
- Réactions secondaires au niveau de M:
- OH ML; ML2…..
- M
- L MOH; M(OH)2 …..
- Réactions secondaires au niveau de L:
- H ML; ML2 ……
- L
- M HL; H2L …..
Remarque:
\begin{align}
{H^+ + L &\rightleftharpoons HL}\cdots(\text{ protonation })\\
β1H &= K1H =\dfrac{[HL]}{[H+][L]}= 1/Ka \\
\log \beta 1H &= \log K1H = pKa\\
\log \beta nH &= \log KnH =
\end{align}
Ex:
\begin{align}
{Ni^{2+} + Y^4- \rightleftharpoons NiY^{2-}} (\text{milieu } {NH_3}/{NH_4^+})
\end{align}
K’: CCS ( voir couplage acide-base/Complexation)
M’ = ? (MOH; M(OH)2 [/latex]\cdots[/latex]+ M)
L’ = ? (HL; H2L [/latex]\cdots[/latex]+ L)
Dissociation des Complexes; notion de pL
prévision des réactions:
\begin{align} {M_mL_n &\rightleftharpoons mM + nL } \qquad (KD ; KS)\ m &= n = 1 \text{ et } L = {Y^4-}\\ p(L) &= p(Y^{4-}) = pK_D + \log \dfrac{[M]}{[MY]} \end{align}
Échelle de pKd
\begin{table}
ntering
\begin{tabular}{lllll}
Donneur Fort & {{LiY^3-}} & {Li^+} & & [/latex]pK_D = 2,8[/latex] \\
&{MgY^{2-}} & { Mg^{2+}}& & [/latex]pK_D = 8,7[/latex]\\
& {ZnY^{2-}} & {Zn^{2+}}& & [/latex]pK_D = 16,3[/latex] \\
&{FeY^-} & {Fe^{3+}}& Accepteur Fort & [/latex]pK_D = 25,1[/latex]\\
\end{tabular}
\end{table}
Ex:
\begin{align}
{ZnY^2- + Fe^3+ &\rightleftharpoons FeY^- + Zn^2+} \\
K&= \dfrac{[FeY^-] [Zn^{2+}]}{[ZnY^{2-}] [Fe^{3+}]}\times \dfrac{[Y^{4-}]}{[Y^{4-}]}= \dfrac{K_{Zn}}{K_{Fe}} =10^9
\end{align}
[FeY- pKD-2 pKD pKD+2 Fe3+ p(Y4-)
Déplacement de M1L peu stable par M2 pour former {M_2L} très stable
Influence de la concentration sur Kd:(ML; {C_0} et [/latex]\alpha[/latex] )
\begin{table} ntering \begin{tabular}{ccccc} ML& [/latex]\rightleftharpoons[/latex] & M & + & L \\ {C_0}& & - & & - \\ [/latex]{C_0}(1-\alpha )[/latex]& & [/latex]\alpha C_0[/latex] & & [/latex]\alpha C_0[/latex] \\ \end{tabular} \end{table}
[/latex]\dfrac{K_D}{C_0} = \dfrac{\alpha^2}{1-\alpha} [/latex]
- Plus [/latex]K_D[/latex] grand, plus [/latex]C_0[/latex] petit plus le complexe se dissocié.
- Un excès de L favorise la formation de ML
Relation entre structure et stabilité
Ion coordinateur
Petite dimension; sym. et charge élevée;
Faible électronégativité.
Ligand
- Minéraux : pas de règle générale (pouvoir donneur)
- Chélates:
- Rapport (L/M) ex: {CuEDTA =1} et {Cu(NH_3)_4 = 4} ;
- Nombre de cycles;
- Nombre d’atomes du cycle (hexa.,penta.);
- Nature des atomes donneur (N, O et S, P, As)
NB: Complexation: essais limites , (détermination des métaux lourds)
Share this content:
Table des matières

