Chromimétrie
Aspects généraux
Le dichromate de potassium K2Cr2O7 n’est pas un agent oxydant aussi puissant que le KMnO4 , mais il présente de grands avantages :
- Étalon primaire très stable,
- Solutions indéfiniment stables si l’on empêche toute évaporation,
- Non réduit par l’HCl si sa concentration n’excède pas 1M,
- Peu affecté par la présence de substances organiques,
- Solutions stables à la lumière.
En solution acide, la réduction du dichromate de potassium s’écrit :
\begin{align}Cr_2O_7^{2-} + 14H^++6e^- \rightleftharpoons 2Cr^{3+}+7H_2O \quad E^\circ (Cr_2O_7^{2-}/2Cr^{3+}) = 1,353 V \text{ à } pH=0 \end{align}
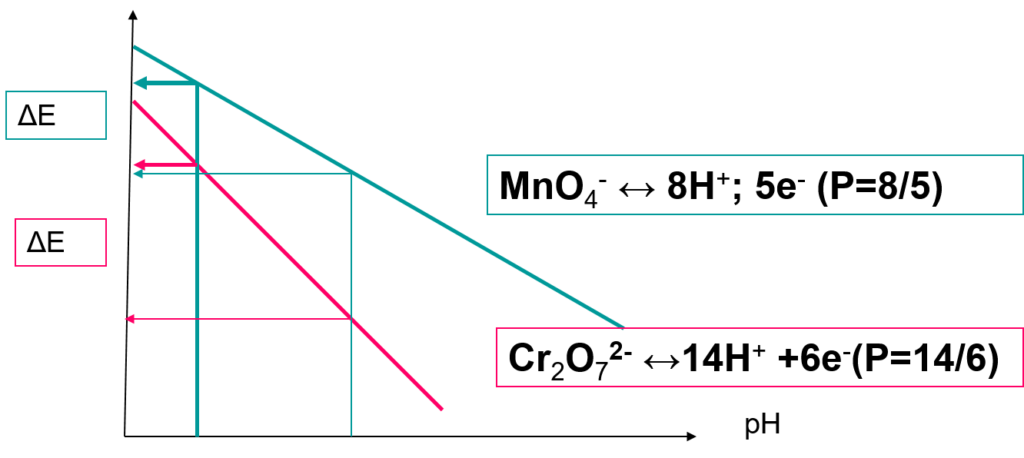
En solution acide, le dichromate est considéré comme « le plus faible des oxydants forts ».
Le pouvoir oxydant diminue fortement avec l’augmentation du pH.
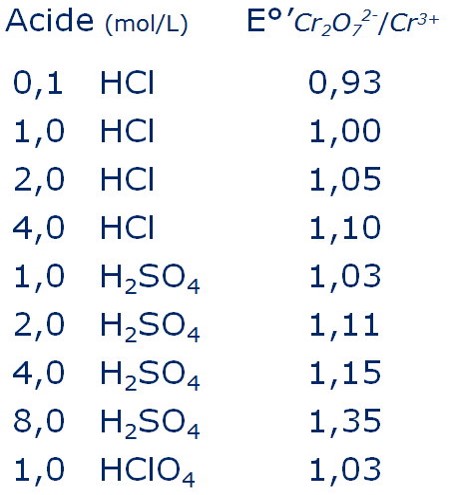
On démontre que le potentiel normal apparent E’° est de :
\begin{align} E^{\prime 0}_{(Cr_2O_7^{2-}/Cr^{3+})} = E^0_{(Cr_2O_7^{2-}/Cr^{3+})} - 0,14 . pH \end{align}Il varie aussi en fonction de l’acide utilisé et sa concentration:
Cl_2 /Cl^- E^\circ =1,36 V dosage de FeCl_2 est-il possible ?
Les 2 potentiels sot proches doc on peut doser en présence de HCl concentré ou de doser des métaux sous forme de chlorures.
Le chrome III a une coloration verte caractéristique mais insuffisante pour bien distinguer le point de fin de titrage. On doit utiliser un indicateur redox donnant un changement de couleur net :
Acide N-phénylanthranilique (solution à 0,1% dans NaOH à 0,005 M)
Diphénylamine-4-sulfonate de sodium (solution à 0,2%) en présence d’ H3PO4.
En chromimétrie on utilise généralement des dosages en retour.
La substance à analyser est mise en contact avec un excès d’ion bichromate la quantité d’oxydant qui n’a pas réagi est doser par iodométrie en mettant à profit le pouvoir oxydant du bichromate sur I– en présence d’un excès des iodures, il y a libération quantitative de I2 qui sera doser par une solution titrée de thiosulfate.
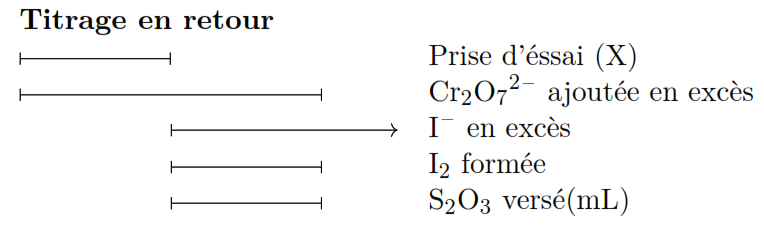
Préparation des solutions titrées
Le dichromate de potassium K2Cr2O7 est disponible à une pureté de plus de 99,9%.
Pour une solution 0,1N \longrightarrow \dfrac{M}{60} .
- Pulvériser finement dans un mortier en verre ou en agate quelques gramme du sel et faire sécher la poudre à 140-150°C pendant 30 min.
- Laisser refroidir dans un dessiccateur
- Préparer la solution de molarité voulue par pesée exacte et dissolution dans le volume adéquat d’eau distillée (fiole jaugée).
L’étalonnage de cette solution n’est pas nécessaire si le sel utilisé est de pureté suffisante et si la pesée a été réalisée avec précision, sinon on étalonne par le sel de Mohr.
Étalonnage
Par le sel de Mohr (NH4+)2 Fe(SO4)2
Étalonnage(si nécessaire)
En milieu acide phosphorique :
\begin{align}Cr_2O_7^{2-} +6Fe^{2+} +14H^+ \rightleftharpoons 2Cr^{3+}+6Fe^{3+}+7H_2O \end{align}
Indicateur : Diphénylamine sulfonée, virage vert au mauve (la coloration verte est du aux sels de chrome)
Par les iodures en milieux acide sulfurique
Les iodures sont ajoutés en excès. Le diiode formé est titré par une solution de thiosulfate.
\begin{align}Cr_2O_7^{2-} +3I^- + 14H^+ \rightleftharpoons 2Cr^{3+}+3I_2+7H_2O\end{align}
Applications
minérales
Fe2+
Milieu HCl , (H3PO4 augmente le rendement).
Pb2+
Action indirecte : pouvoir précipitant du bichromate en milieu acétique vis-à-vis de certains ions (Pb2+, Ba2+ …..)
En milieu acétique, on oppose aux ions à doser une quantité en excès d’ion bichromate, après précipitation totale et séparation du précipité par filtration et lavage de ce dernier, l’excès du bichromate est titrés en ajoutant à un excès de I– , l’iode I2 libéré sera titré par une solution de Na2S2O3.
Il est également possible de recueillir quantitativement le précipité , et de le laver par l’acétate d’ammonium pour le débarrasser de l’excès de Cr2O72- , il suffit alors de remettre quantitativement le précipité en solution dans HCN 5N et titré le Cr2O72- par Fe2+ .
Exemple:
\begin{align} 2Pb^{2+} + Cr_2O_7^{2-} + H_2O \rightleftharpoons 2CrO_4Pb + 2H^+ \end{align}
- Doser l’excès de Cr2O72- par I^- / I_2 / S_2O_3^{2-}
- ou Peser du précipité (gravimétrie)
- ou Traiter le précipité
- Filtrer , laver par l’acétate d’ammonium
- Dissoudre / HCl (5N), doser Cr2O72- par Fe2+
- 1 L de Cr2O72- 0,1N \longleftrightarrow \dfrac{1}{60} mole \longleftrightarrow \dfrac{1}{30} mole Pb2+
Organiques
Alcoolémie par méthode de Cordebard
C’est méthode officielle, la séparation de l’alcool du sang par distillation en présence d’acide picrique (précipite les protéines). Le distillat est traité par une solution en excès de dichromate de potassium dans l’acide nitrique.
Temps de contact (15 min), il faut utilisé un essai blanc.
\begin{align} CH_3CH_2OH +H_2O &\rightleftharpoons CH_3COOH+4H^++4e^- \qquad (\times 3)\\ 3CH_3CH_2OH+2Cr_2O_7^{2-} + 16H^+ &\rightleftharpoons 3 CH_3COOH+ 4Cr^{3+}+11H_2O \end{align}
L’excès de Cr2O72- est apprécié par réaction avec I– et dosage de I_2 généré par S2O32-.
1L de Cr2O72- 0,1N \longleftrightarrow \dfrac{1}{40} mole en C2H5OH .
Alcoolémie par méthode de Nicloux
\begin{align} 3CH_3CH_2OH+2Cr_2O_7^{2-} + 16H^+ \rightleftharpoons 3 CH_3COOH+ 4Cr^{3+}+11H_2O \end{align}
En milieu sulfurique et à 45°C, la réaction se fait avec le bichromate en excès.
La solution est refroidie et on ajoute une solution de Fe2+ en excès.
L’ excès de Fe2+ est dosé par le permanganate.
Il est nécessaire d’effectuer un essai blanc en parallèle
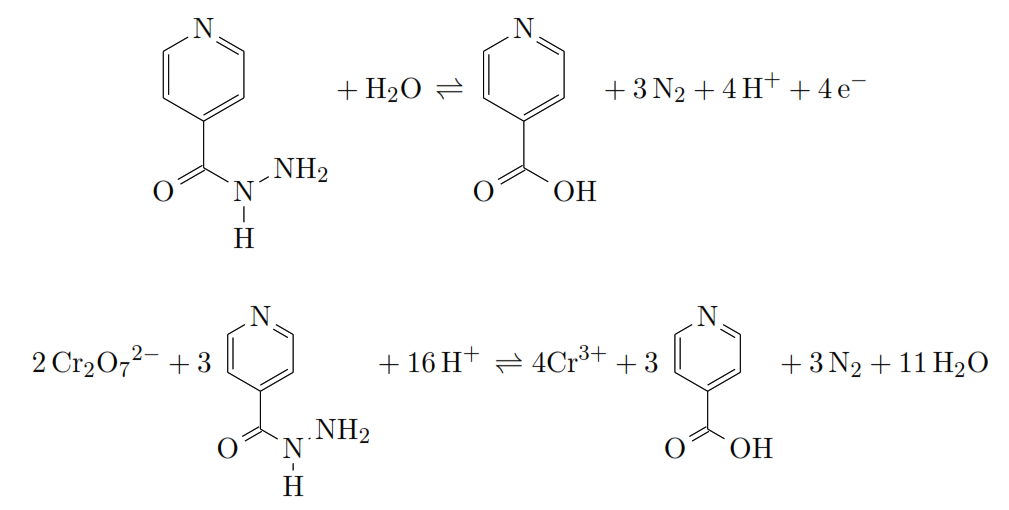
Dosage de l’isoniazide
Share this content:
Table des matières

