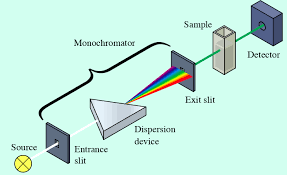
Spectrophotométrie d’absorption moléculaire Uv – Visible
Aspect théorique
Orbitale moléculaire (rappels)
Les orbitales moléculaires se forment par combinaison linéaire des orbitales atomiques (O.A) ou plus communément la CLOA.
Le rapprochement des atomes entraîne le recouvrement des O.A, on a formation d’orbitales moléculaires (O.M).
Pour que le recouvrement des O.A puisse se faire il faut que ces O.A aient des niveaux d’énergie voisins et il faut une orientation correcte des orbitales dans l’espace. Lorsque deux O.A se combinent, elles donnent 2 O.M:
- une liante : d’énergie inférieure à celle des O.A
- une anti-liante, d’énergie supérieure à celle des O.A

Lorsqu’on a une combinaison des orbitales
- les OA s donnent des O.M \sigma et \sigma*
- les OA pz donnent des O. M \sigma et \sigma*
- les O.A px et py donnent des OM \pi et \pi* (\pi_x et \pi_y)
Pour les molécule organiques:
On explique la similitude des propriétés chimiques des liaisons par la formation d’orbitales hybrides à partir desquelles on forme des O.M identiques.
En présence d’une simple liaison C-C, on a formation de 4 orbitales hybrides sp3 qui vont donner lieu à la formation de 4 orbitales moléculaires liantes \sigma et 4 O.M antiliantes \sigma*.
Pour une double liaison C=C : 3 orbitales hybrides Sp2
- 1 OA s + 2 OA p \longrightarrow3 OM \sigma liantes + 3 OM \sigma* antiliantes
- 1 orbitale px reste libre, elle donne 1 OM liante \pi et antiliante \pi*.
Pour une triple liaison C \equiv C : orbitale hybride sp.
- 1 OAs + 1 OAp \longrightarrow2 OM \sigmaet 2 OM \sigma*
- 1 OA px et 1 OA py restent libres et donnent 2 O.M \pi et \pi*
Lorsqu’on a des hétéroatomes, il y a formation d’orbitales non liantes (n). Ex: O, S, N…
Exemple: Formol H2C = O
Orbitales présentes:
- atome O: s , px, py et pz
- atome C: 3 orbitales Sp2 et l’orbitale px est libre
Nature des OM obtenues
- Orbitales sp2 :OM \sigma et \sigma*
- Orbitales px: O.M \pi et \pi*
Sur les 3 orbitales sp2 du C , 2 se combinent avec les 2 H: deux OM \sigma et deux OM \sigma*.
La 3ème orbitale, sp2 se combine avec l’orbitale s de l’oxygène (O) pour donner une OM \sigma et une OM \sigma*.
L’orbitale px libre du C se combine avec px ou py de O pour donner une OM \pi et une OM \pi*.
Pour O, il reste deux OA non liantes (n) dont les énergies sont souvent intermédiaires entre les niveaux d’énergie des OM \pi et \pi*.
Les niveaux d’énergie
Les orbitales de plus faible énergie sont remplies en priorité par les électrons. On a au maximum 2 électrons par orbitale. Ces électrons sont de spins opposés.
A l’état fondamental, seules les orbitales liantes et non liantes peuvent être occupées.

Les transitions électroniques
Elles correspondent au passage d’un électron d’une orbitale liante ou non liante à une orbitale anti-liante.
Ces passages vont se faire suivant plusieurs conditions.
La possibilité de passage d’une orbitale à une autre orbitale dépend de la différence d’énergie entre les 2 orbitales et de l’orientation des orbitales dans l’espace.
- 1ère transition \sigma \longrightarrow \sigma*: possible. Mais On ne peut pas l’observer sur un spectre UV-Visible, car son énergie correspond à une longueur d’onde inférieure à 200 nm.
- 2ème transition \sigma \longrightarrow \pi* : impossible, les orientations ne sont pas les mêmes
- 3ème transition \pi \longrightarrow \sigma*: impossible, les orientations ne sont pas les mêmes
- 4ème transition \pi \longrightarrow \pi*: existe, observable car la différence d’énergie est faible (domaine de longueur d’onde voisin de 200 nm)
- 5ème transition n \longrightarrow \sigma*: existe, mais non observable ; car la longueur d’onde < 200 nm
- 6ème transition n \longrightarrow \pi*: existe, observable car la différence d’énergie est faible. Présente, lorsqu’il y a des hétéro-atomes dans la molécule
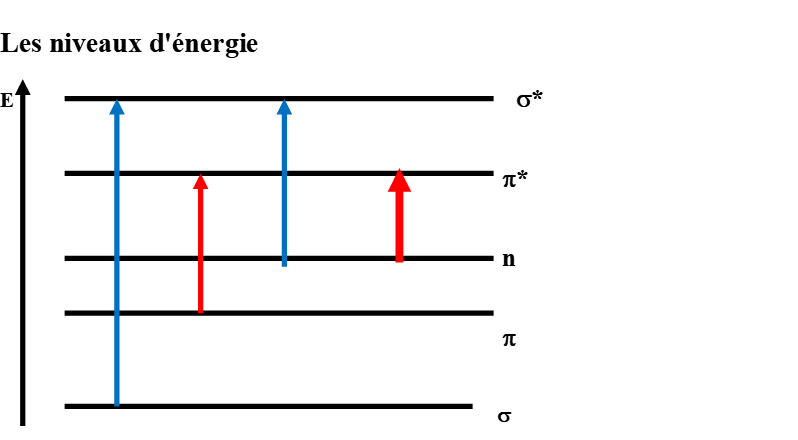
Transitions par ordre d’énergie croissante:
- observables n \longrightarrow \pi* et \pi \longrightarrow \pi*
- non observables n \longrightarrow \sigma* et \sigma \longrightarrow \sigma*
Share this content:
Table des matières