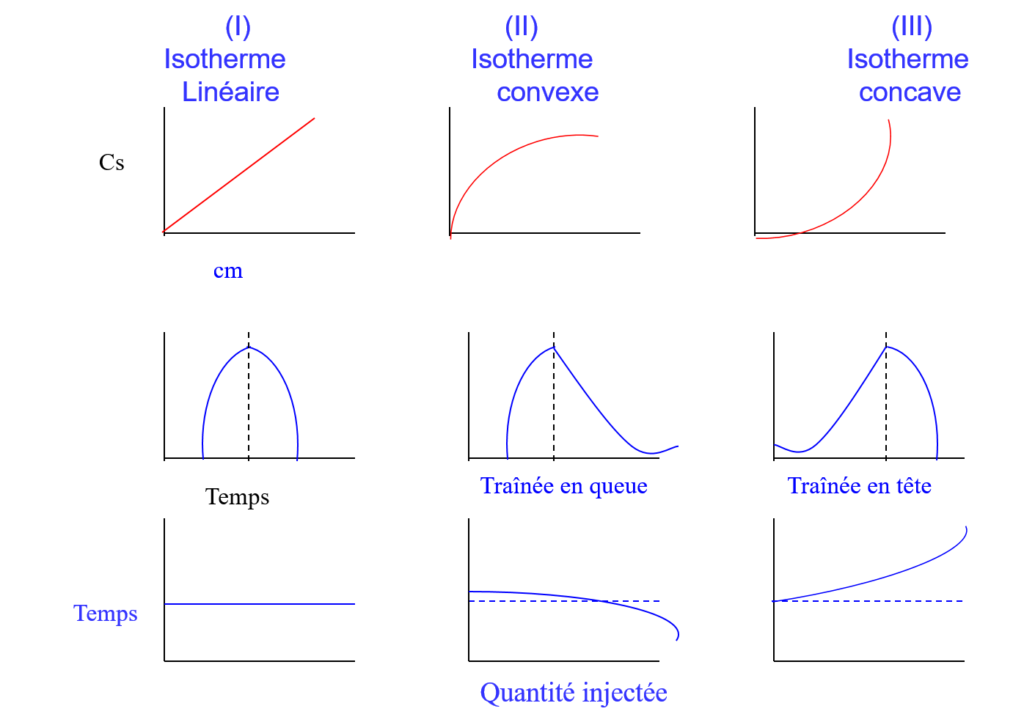
Chromatographie: Aspects généraux
Généralités
Définition
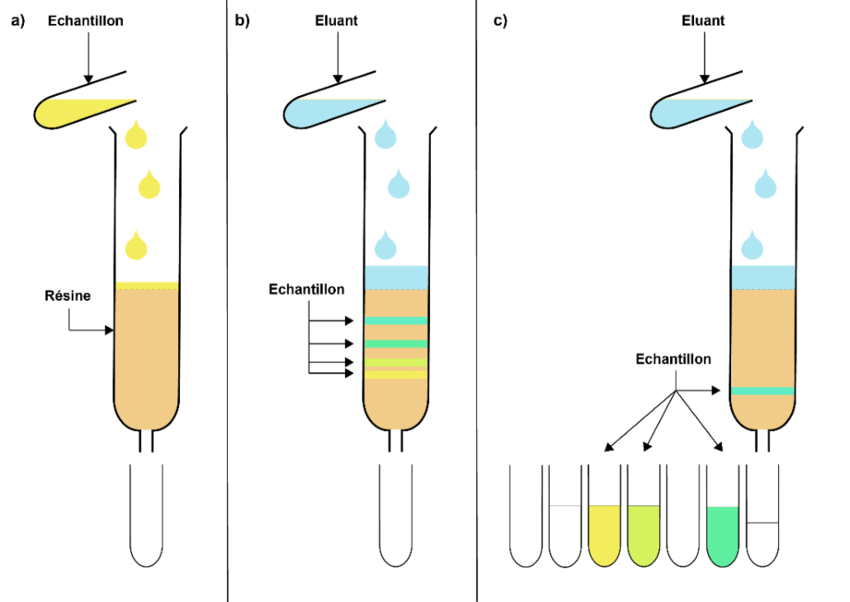
La chromatographie sous toutes ses formes, est une
méthode de séparation des constituants d’un mélange gazeux, liquide ou solide. C’est une méthode de séparation, donc d’analyse, basée sur les différences d’affinités que peuvent présenter deux ou plusieurs composés pour deux phases, l’une fixe ou stationnaire et l’autre mobile.
La chromatographie est essentiellement une technique de séparation physique dont le champ d’application en analyse quantitative est restreint aux situations où la composition du mélange à séparer est connue. Pour identifier des composés séparés par chromatographie, lorsqu’on ignore tout de leur structure chimique, il est fréquent de coupler à la séparation comme telle, une technique d’analyse complémentaire comme par exemple la spectrométrie de masse ou la spectroscopie infrarouge.
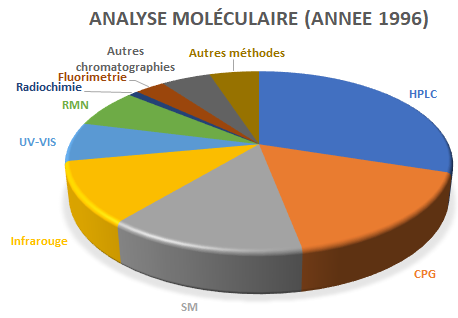
La statistique ci-dessus fait apparaitre que la chromatographie, à elle seule , représente plus de la moitié du chiffre d’affaires de l’instrumentation d’analyse moléculaire.
Principe général de tous les types de chromatographie
Classement selon la nature des phases et processus mis en jeu
| Phase mobile | Phase stationnaire | Méthode chromatographique |
| Gaz | Solide | C.G.S |
| Gaz | Liquide | C.G.L |
| Liquide | Solide | C.L.S |
| Liquide | Solide | C.L.L |
| Mécanismes | Méthodes chromatographiques |
| Adsorption | L.G.S et C.L.S |
| Partition | C.G.L et C.L.L |
| Échanges d’ions | C.L.S |
| Perméations | C.L.S |
Classement selon les techniques opératoires
- Chromatographie sur couche mince ou sur papier;
- Chromatographie sur colonne;
- Chromatographie par perméation de gel ou d’exclusion (polymères);
Classement selon la méthode d’injection de l’éluât
- Chromatographie pulsée ou d’élution;
- Chromatographie frontale
Historique
Il existe peu d’exemple de développement d’un procédé ou d’une méthode aussi extraordinaire que celui de la chromatographie.
Quelques dates importantes :
- 1906 : Description et découverte de phénomène chromatographique par M. TSWETT
- 1952 : Première chromatographie gazeuse (MARTIN et JAMES)
- 1967 : Début de la chromatographie liquide haute performance (HUBER et HUZSMAN)
Buts de la chromatographie
- Chromatographie analytique : analyses qualitatives et quantitative (recherche, laboratoire, fabrication)
- Chromatographie préparative (recherche, synthèse).
Comparaison chromatographie Gazeuse/Chromatographie liquide
Les deux techniques de base de la chromatographie ne sont pas compétitives mais tout à fait complémentaires.
- Quelques avantages de la Chromatographie liquide :
- Possibilité de chromatographier les produits thermolabiles et les produits de haute masse molaire.
- Dérivation des produits peut être automatisée
- Mode préparatif facile à mettre en œuvre
- Quelques avantages de la chromatographie gazeuse :
- Détecteurs spécifiques et sensibles
- Couplage avec spectrométrie
- Possibilité d’analyser les produits de très faibles masses molaires.

Théorie de la chromatographie
La théorie générale de la chromatographie peut être longue et complexe à exposer. En outre, chaque méthode chromatographique possède sa théorie et ses mécanismes propres. Nous présentons seulement dans ce chapitre les grandeurs fondamentales de la chromatographie (sous toutes ses formes) qui sont des éléments théoriques indispensables au praticien.
Comment améliorer une séparation en chromatographie ?
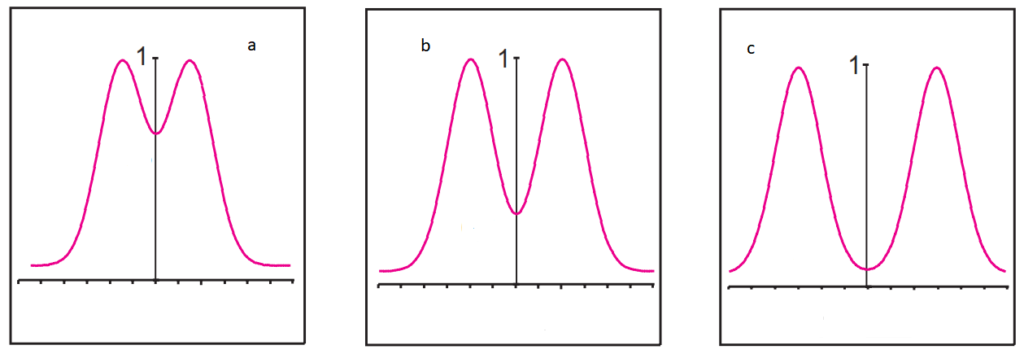
Il y a deux possibilités pour améliorer la séparation entre les 2 pics du chromatogramme (a) :
- A largeur de pic constante, on peut augmenter la différence de temps de rétention entre les 2 pics, ceci est illustré dans chromatogramme (b)
- A temps de rétention constant, on peut diminuer la largeur des pics, le chromatogramme (c) illustre ce phénomène.
En pratique, on peut jouer à la fois sur ces 2 paramètres pour améliorer une séparation.
En conclusion, deux paramètres s’avèrent donc primordiaux en chromatographie, la rétention et la forme du pic.
Paramètres caractérisant la rétention
Le chromatogramme du Prozac® (antidépresseur) de la figure \ref{prozac} a été enregistré dans les conditions suivantes :
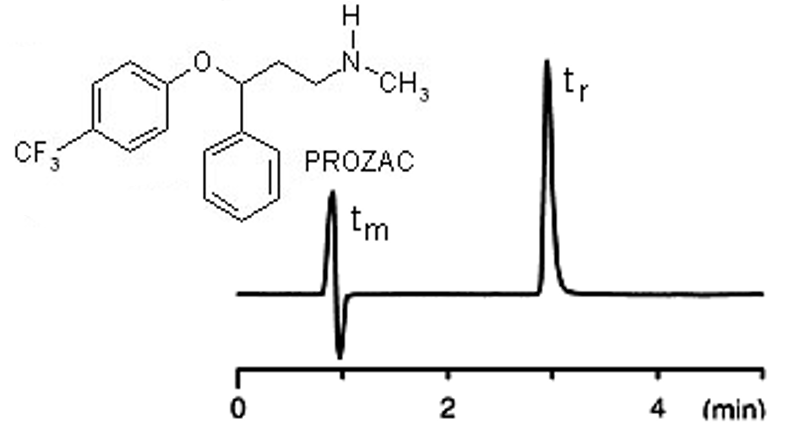
- Colonne C18: 15cm x 4,6mm;
- Phase mobile: acetonitrile / 25mM KH2PO4 pH 7,0 (40:60);
- Débit: 2mL/min;
- Température: 30°C ;
- Détecteur UV : 254 nm;
- Injection: 1\muL
Le temps de rétention
Le temps de rétention tr d’un produit S est le temps écoulé entre le début de l’injection et la sortie du produit. (pour le chromatogramme de la figure \ref{prozac}, tr = 3mn)
tr dépend du produit S et des conditions expérimentales (colonne, température, débit de phase mobile… etc.)
Le volume de rétention
Le volume de rétention Vr correspond au volume de phase mobile nécessaire pour éluer le produit S.
Si D est le débit de la phase mobile (D supposé constant) :
\begin{align}V_r = t_r \times D \end{align}
(pour le chromatogramme de la figure \ref{prozac}, Vr = 3 * 2 = 6 ml)
Le temps mort
Le temps mort t_m est le temps que met la phase mobile pour traverser la colonne. (dans la figure \ref{prozac}, tm = 1mn). La phase mobile est caractérisée par sa vitesse linéaire u de déplacement dans la colonne de longueur L, on a :
\begin{align} u=\dfrac{L}{t_m} \end{align}(pour le chromatogramme de la figure \ref{prozac}, u= 15 cm/mn)
En CPG, le temps mort correspond au temps de rétention de substances non retenue par la phase stationnaire comme l’air ou le méthane.
Le volume mort
On appelle volume mort Vm le volume de phase mobile qui passe à travers la colonne pour aller d’une extrémité à l’autre de la colonne (pendant le temps tm). Autrement dit, Vm est le volume occupé par la phase mobile dans une colonne.
\begin{align}V_m = t_m \times D \end{align}(pour le chromatogramme de la figure \ref{prozac}, Vm = 1 * 2 = 2 ml). Vm ne dépend que de la géométrie et du remplissage de la colonne.
Volume et temps de rétention réduits
On appelle volume de rétention réduit V^{\prime}_r,
la différence entre les termes Vr et Vm.
(pour le chromatogramme de la figure \ref{prozac}, V^{\prime}_r= 4ml ).
Le volume de rétention réduit correspondant au produit S est le volume de phase mobile qui doit passer à travers la colonne pour éluer ce composé.
De la même façon, on définit un temps de rétention réduit t’r.
\begin{align}t^{\prime}_r = t_r - t_m \end{align}(pour le chromatogramme de la figure \ref{prozac}, t’r = 2 mn), les volumes et temps de rétention réduits sont indépendantes des volumes et temps morts, elles dépendent donc moins de l’instrumentation (de la colonne).
Le facteur de rétention (ou de capacité)
Si on représente la colonne de chromatographie comme un milieu hétérogène constitué de deux phases non miscibles, l’une fixe et l’autre mobile et si on introduit dans ce milieu un composé présentant des affinités envers les deux phases, il s’établira, en chaque point de la colonne, un équilibre entre la concentration de ce composé dans la phase mobile et sa concentration dans la phase stationnaire. Le rapport de ces concentrations à l’équilibre est le coefficient de partage K.
Le facteur de rétention K’ pour un produit donné est défini comme suit :
Les facteurs de rétention sont des grandeurs sans dimension donc plus générales d’un produit donné que les temps ou les volumes de rétention réduits.
(pour le chromatogramme de la figure \ref{prozac}, K’ = 2).
D’où une définition du facteur de rétention d’après l’équation \ref{facteur_retention} C’est le rapport du temps passé par le soluté dans la phase stationnaire sur le temps passé par ce même soluté dans la phase mobile
Interprétation thermodynamique des paramètres de rétention
La constante d’équilibre (ou constante de partition) K
Le problème est le suivant: trouver les relations entre les paramètres de rétention (Vr, K’, t’r et tr) et la constante d’équilibre K caractérisant l’équilibre suivant:
\begin{align}S_m \rightleftharpoons S_s\end{align}
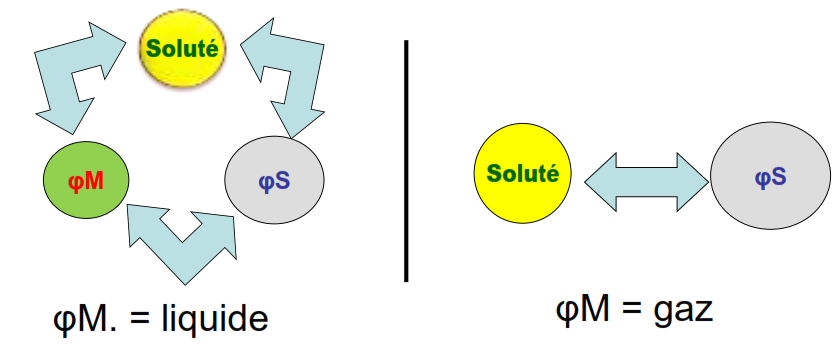
L’élution d’un soluté S en chromatographie est donc caractérisé par la constante d’équilibre K, appelée aussi constante de partition.
\begin{align}K &= \dfrac{[S_s]}{[S_m]}\\ \text{où } [S_s] &= \dfrac{m_s}{V_s} \qquad \text{et } [S_m] = \dfrac{m_m}{V_m}\end{align}- mm: Masse du soluté S dissous dans la phase mobile
- ms: Masse du soluté S dissous dans la phase stationnaire
- Vm: Volume de la phase mobile (équivalent au volume mort)
- Vs: Volume de la phase stationnaire
Vm et Vs sont constants pour une colonne donnée avec une phase stationnaire donnée
\begin{align}\beta =\dfrac{V_m}{V_s}\end{align}Le paramètre \beta, appelé rapport de phases est une constante qui caractérise une colonne de chromatographie.
\beta sera calculé par la suite pour une colonne capillaire en chromatographie en phase gazeuse.
Le facteur de rétention K’
\begin{align}K^{\prime}= \dfrac{V_r}{V_m} - 1\end{align}D’après l’équation \ref{facteur_retention}, on déduit que si on suppose que Vr est proportionnel à la masse totale de soluté dissous dans la phase stationnaire et dans la phase mobile.
On a donc Vr proportionnel à (ms + mm)
De la même façon, si on suppose que Vm est proportionnel à la masse de soluté dissous dans la phase mobile.
On a donc Vm proportionnel à mm
On en déduit que
\begin{align}K^{\prime}= \dfrac{m_s + m_m}{m_m} - 1=\dfrac{m_s}{m_m}\end{align}et d’après l’équation \ref{cste_part_beta}, on a donc:
\begin{align}K^{\prime}=\dfrac{m_s}{m_m}=\dfrac{S_s\cdot V_s}{S_m\cdot V_m}= K \cdot\dfrac{V_s}{V_m}=\dfrac{K}{\beta}\end{align}ce qui nous donne une relation fondamentale de la chromatographie
\begin{align}K^{\prime}=\dfrac{K}{\beta} \label{kprime_fct_beta} \end{align}Le temps de rétention tr
D’après les équations \ref{vol_tps_retention} et \ref{kprime_fct_beta}, on déduit que:
\begin{align}t^{\prime}_r&=t_m\cdot \dfrac{K}{\beta}\\\text{et}\qquad t_r&=t_m (1 + \dfrac{K}{\beta})\label{tps_ret_beta}\end{align}La dernière expression est cohérente, si un produit n’a aucune affinité avec la phase stationnaire :[Ss] = 0 donc K = 0 et tr = tm .
Ceci est le cas de l’air ou en première approximation du CH4 en CPG, ce qui permet la mesure du temps mort.
Influence de la température sur les temps de rétention réduits t’r
K varie avec la température T suivant l’équation classique \ref{k_fct_t},
où G° est la différence d’énergie libre de dissolution du soluté S entre les 2 phases. K est >> 1 donc G° est négative.
En combinant cette expression avec l’équation \ref{tps_ret_beta}, on trouve la relation entre le temps de rétention réduit et la température :
\begin{align}\ln t^{\prime}_r= \dfrac{-\Delta r G^\circ}{RT} - \ln \beta {+}\ln t_m\label{tprimer_fct_beta}\end{align}Où G° est la différence d’énergie libre de dissolution du soluté entre les phases mobile et stationnaire.

Plus ΔG° (dissolution pm→ ps) est petit (grand en valeur absolue), plus la constante d’équilibre K est grande, plus le produit est retenu sur la colonne, plus le tr est grand
D’après la figure \ref{dissolution}, il apparaît que pour avoir une séparation chromatographique,
il faut que :
ΔG° (dissolution pm → ps) <0 soit ΔG° (dissolution ps) < ΔG° (dissolution pm) ou en valeur absolue ΔG° (dissolution ps) >ΔG° (dissolution pm)
G°(dissolution pm → ps) est fonction de la température, en effet ΔG°= ΔH° – T. ΔS°, si l’on suppose que ΔH° et ΔS° sont indépendants de la température, la formule de l’équation \ref{tprimer_fct_beta} devient:
\begin{align}\ln t^{\prime}_r = - \dfrac{\Delta H^\circ}{RT} + \dfrac{\Delta S^\circ}{R} - \ln \beta {+} \ln t_m \label{tprimer_fct_t_enthalpie_beta}\end{align}Soit:
\begin{align}\ln t^{\prime}_r = \dfrac{A}{T} + B\end{align}où A et B sont des constantes pour un produit donné et une colonne donnée.
Considérons deux températures T1 et T2 où T2 > T1
avec les facteurs de rétention correspondants K’1 et K’2, la formule devient :
Comme t’r1 > t’r2, on voit que ΔH° est toujours < 0.
Le temps mort tm, peut être supposé indépendant de la température pour une colonne donnée et une pression donnée.
En réalité, lorsque la température augmente, le mouvement brownien augmente, la viscosité de la phase mobile diminue et sa vitesse augmente légèrement dans la direction de la colonne. On observe expérimentalement une faible augmentation du temps mort avec la température.
Exercices d’application
inserer QUIZ
La forme des pics en chromatographie
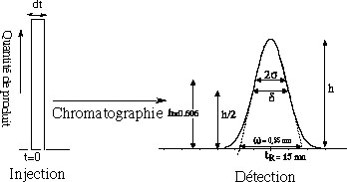
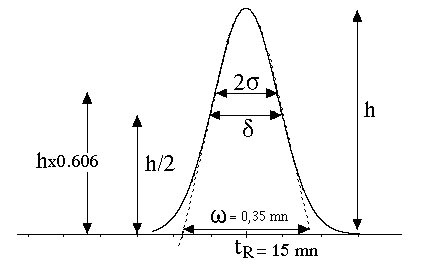
Au moment de l’injection, de durée (dt), le « futur » pic de chromatographie a un profil rectangulaire ; à la sortie de la colonne, il se retrouve déformé suivant une loi statistique, approximativement « normale », c’est une courbe de Gauss.
L’équation mathématique y=f(t) de la courbe de Gauss est:
\begin{align}y= \dfrac{1}{2\pi} e^-{\left( \dfrac{t^2}{2}\right) }\end{align}Une courbe de Gauss est caractérisée par les paramètres suivants: (Cf figure \ref{profil_des_pics}).
- Écart-type = s. L’écart type s correspond à la moitié de la largeur du pic mesuré à 60,6% de sa hauteur.
- Variance = s2
- Largeur à mi-hauteur = \delta mesurée à h/2. On a la relation:\begin{align}\delta = 2,35 \cdot s\end{align}
- la « base » du pic = \omega. Cette base est extrapolée par des tangentes aux deux branches et passant par les points d’inflexion de la courbe de Gauss. On a la relation:\begin{align}\omega = 4 \cdot s\end{align}
Une conséquence de la loi statistique ( normale ) est que 95,4% des valeurs de tr du pic se trouve dans l’intervalle[tr – 2s ; tr + 2s].
Modèle des plateaux théoriques
Vers 1950, MARTIN et SYNGE ont tenté de justifier la forme des pics de chromatographie, en assimilant une colonne de chromatographie à une colonne à distiller. Ce qui s’est avéré inexact par la suite (les 2 phénomènes sont physiquement différents)
Notion de plateaux théoriques
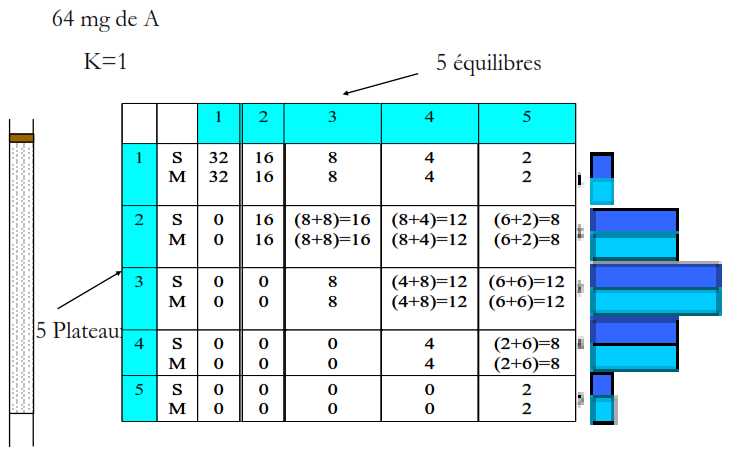
Une colonne de N plateaux théoriques est une colonne divisée en N petits disques cylindriques successifs. On admet que la phase mobile progresse non pas de façon continue, mais par sauts successifs d’un plateau théorique à l’autre. Dans chaque plateau théorique, on observe une rétention du soluté S, du fait de l’équilibre de ce produit entre la phase mobile (Spm) et la phase stationnaire (Sps).
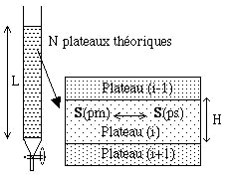
Une colonne réelle aura donc « N plateaux théoriques » si elle se comporte comme une « colonne à distiller théorique » de N plateaux.
Dans cette théorie, les pics de chromatographie ont une forme gaussienne et la variance s2 est reliée au nombre de plateaux théoriques N et au temps de rétention tr par la relation:
N augmente donc avec le temps de rétention et diminue si la largeur des pics (s) augmente. D’après la relation \ref{tps_retention}, une « bonne » colonne de chromatographie qui conduit à des pics fins (s petit) pour des temps de rétention (tr) élevés, est donc caractérisée par un nombre de plateaux théoriques N élevé.
Formule \ref{omega} utilisant la base extrapolée [/latex]\omega[/latex] du pic
\begin{align}N = 16\left(\dfrac{t_r}{\omega}\right)^2\label{omega}\end{align}
Formule \ref{delta} utilisant la largeur à mi hauteur [/latex]\delta[/latex] du pic
\begin{align}N= 5,54\left(\dfrac{t_r}{\delta}\right)^2\label{delta}\end{align}
Formule \ref{hp} utilisant la hauteur hp et l’aire A du pic
\begin{align}N= 16\left( \dfrac{hp \cdot t_r}{A}\right)^2\label{hp}\end{align}
(\omega, \delta , hp, A et tr doivent être exprimés dans la même unité).
L’intérêt de la notion de plateaux théorique est de nous donner une idée de l’efficacité d’une colonne, mais seul l’ordre de grandeur de N est à prendre en compte. Bien que cette notion de plateaux théoriques soit issue d’une théorie qui s’est avérée inexacte, elle est toujours utilisée car c’est une notion simple et qui bien ancrée dans les habitudes des chromatographistes. Les fabriquants de colonnes donnent toujours dans les spécifications le nombre de plateaux théoriques N pour caractériser l’efficacité de leur colonne. En CPG, N est donné pour un produit donné, souvent le tridécane (C13H28).
Notion de hauteur équivalente à un plateau théorique
Pour exprimer l’efficacité d’une colonne de longueur L et de N plateaux théoriques, on définit la hauteur H équivalent à un plateau théorique:
\begin{align}H = \dfrac{L}{N} \end{align}H est appelé la hauteur équivalente à un plateau théorique (HEPT), ce paramètre varie entre 10 et 0,01 mm. Le paramètre H est intéressant car il est indépendant de la longueur de la colonne. Le tableau suivant montre le pouvoir de séparation des chromatographies les plus utilisées
| Type de chromatographies | Nombre de plateaux théoriques N | N/par mètre de colonne | H (HETP) en mm |
| CPG (colonne remplie de 2m ) | 2000 | 1000 | 1 |
| CPG (colonne capillaire de 25m) | 100000 | 4000 | 0,25 |
| CPL classique de 50 cm | 100 | 200 | 5 |
| HPLC de 10cm | 5000 | 50000 | 0,02 |
Exercice d’application
inserer quiz
Théorie dynamique de la chromatographie
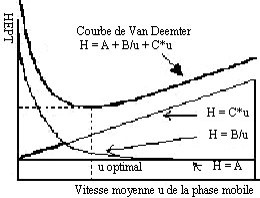
Équation de Van Deemter (1956)
On peut considérer dans le cas de développement d’une évolution
d’une petite quantité de produit que l’étalement du pic au fur et à mesure de sa progression dans la colonne de chromatographie est dû à trois origines indépendantes :
- la résistance au transfert de matière dans chacune des phases
- la dispersion des molécules par diffusion
- l’existence de chemins multiples dus au remplissage.
L’équation de Van Deemter relie les différentes causes d’élargissement des pics à la vitesse de la phase mobile et à la hauteur équivalente à un plateau théorique (efficacité).
Cette équation est de la forme :
\begin{align}H = A + \dfrac{B}{U} + C\cdot U \label{van_demteer} \end{align}où :
- U: La vitesse linéaire moyenne de la phase mobile.
- A : Diffusion turbulente due à l’écoulement de la phase mobile à travers la phase stationnaire
- B : Diffusion longitudinale des molécules au sein de la phase mobile
- C : La résistance au transfert de masse entre les 2 phases.
En colonne capillaire (chromatographie en phase gazeuse) : A = 0
\begin{align} H = \dfrac{B}{U} + C\cdot U \end{align}Influence de la température :
\begin{align} H = A^{\prime} + \dfrac{B^{\prime}}{U} + C^{\prime}\cdot U \end{align}Trois facteurs, représentés par les 3 termes de l’équation \ref{van_demteer}, contribuent à l’élargissement des pics.
Diffusion turbulente. (Terme A)
Suivant la taille et la forme des particules, ils existent pour la phase mobile, plusieurs trajets possibles, cette particularité contribue à l’élargissement des pics, d’où:
\begin{align} A = 2\cdot l\cdot dp \end{align}- l est une constante voisine de 1.
- dp est le diamètre moyen des particules.
Donc, plus les particules sont petites et plus le remplissage est homogène, plus l’efficacité de la colonne augmente.
La contribution de A est nulle pour une colonne capillaire de chromatographie en phase gazeuse.

Diffusion longitudinale. (Terme B)
Le terme \dfrac{B}{u} traduit la dispersion du soluté à cause de la diffusion du soluté dans la colonne.
Par exemple, dans un flux liquide, les molécules au centre du flux progressent plus vite que celles qui sont sur les bords au contact des particules; on a:
\begin{align}B = 2 \cdot g\cdot D_m\end{align}où g est une constante (g<1). et Dm est le coefficient de diffusion du soluté dans la phase mobile. Le terme B/u est évidemment inversement proportionnel à U. L’efficacité d’une colonne augmente avec la vitesse de la phase mobile. Ceci peut expliquer les bonnes séparations obtenues en HPLC; de plus, comme le terme Dm est environ 5 fois plus grand en CPG qu’en CPL, il en résulte que la contribution de la diffusion longitudinale est presque négligeable en HPLC.
Résistance au transfert de masse.(Terme C)
Ce terme C\cdot U représente la résistance au transfert du soluté entre les phases mobiles et stationnaires, cette résistance empêche l’établissement de l’équilibre entre Spm et Sps. Ce phénomène est du par exemple au fait que certaines molécules stagnent dans les pores de la phase stationnaire.
Plus la vitesse (U) de la phase mobile diminue, plus les molécules de soluté peuvent pénétrer dans la phase stationnaire, plus l’équilibre entre les 2 phases est favorisé et plus la colonne est performante. Le terme C est proportionnel à \dfrac{dp^2}{D_m}, les colonnes les plus efficaces seront celles régulièrement remplies et bien tassées où le diamètre des particules est le plus faible possible. Il faut également utiliser des solvants de faible viscosité pour minimiser ce terme.
Courbe de Van Deemter
La représentation graphique de l’équation \ref{van_demteer} est appelée courbe de Van Deemter.
Exercice d’application
Quiz ici
Facteur de séparation de deux pics
Définition du facteur de séparation
Le chromatogramme suivant montre la séparation de 2 solutés A et B.
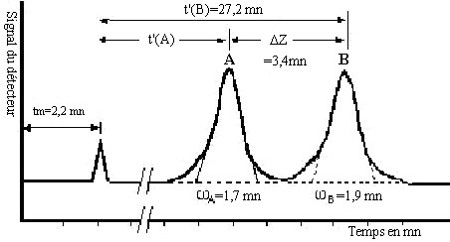
On appelle le facteur de séparation (ou sélectivité) le terme suivant:
\begin{align} \alpha = \dfrac{t^{\prime}_r(B)}{t^{\prime}_r(A)} \label{equ_v9}\end{align}dans lequel t^{\prime}_r(B) > t^{\prime}_r (A) , on a donc \alpha toujours supérieur ou égal à 1. Compte tenu de l’équation \ref{delta}, on a l’expression \ref{equ_v10}, où le facteur de séparation s’exprime en fonction des facteurs de rétention. Ce facteur rend donc compte de la « proximité » des pics sans tenir compte de leur forme.
\begin{align}\alpha = \dfrac{K^{\prime}_B}{K^{\prime}_A} \label{equ_v10} \end{align}Interprétation thermodynamique du facteur de séparation
En utilisant \ref{equ_v9}, on peut exprimer le facteur de séparation \alpha en fonction des coefficients de partition (ou constantes d’équilibre K) des solutés A et B :
\begin{align}\alpha = \dfrac{K^{\prime}_B}{K^{\prime}_A}= \dfrac{K_B}{K_A} \label{equ_v11}\end{align}L’expression \ref{equ_v10} permet d’obtenir le facteur de séparation en fonction de la température:
\begin{align}RT \cdot \ln a = -(\Delta G^\circ(B) -\Delta G^\circ(A)) \label{equ_v12}\end{align}Le terme a traduit donc la différence d’énergie libre de dissolution des solutés A et B. Comme a est très voisin de 1, on peut souvent utiliser l’expression simplifiée
\begin{align}\ln a \approx (\alpha {-} 1)= -\dfrac{\delta (\Delta G^\circ)}{RT}\label{equ_v13}\end{align}Définition du facteur de résolution
Par convention le facteur de résolution R des 2 pics A et B de la figure \ref{pic_chromato}, s’écrit :
\begin{align} R&=2 \left( \dfrac{t^{\prime}_r(A) - t^{\prime}_r(B)}{\omega_A + \omega_B} \right) \\ &=2 \left( \dfrac{t_r(A) - t_r(B)}{\omega A +\omega B} \right) \\ &=2 \left( \dfrac{\Delta Z}{\omega_A + \omega_B} \right) \end{align}Si on fait apparaître la largeur à mi-hauteur \delta, on a :
\begin{align} R = 1,18 \left( \dfrac{t_r(A) - t_r(B)}{\delta_A +\delta_B} \right)\end{align}Contrairement à \alpha le terme R prend en compte la forme des pics et leur recouvrement éventuel.
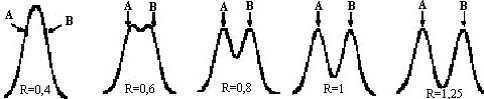
La figure \ref{figure_v_2} montre l’influence de la résolution R sur la séparation de 2 pics de même intensité. Pour une résolution inférieure à 0,6 les pics ne sont pas séparés. En pratique une bonne résolution suppose que R \geq 1,5.
Dans le cas de 2 pics A et B très proches (t_r(A) \approx t_r(B) \text{ et } \omega_A \approx \omega_B), en combinant les expressions \ref{omega}, \ref{equ_v9} et \ref{equ_3_6}, on obtient la relation de Purnell, une expression de la résolution R en fonction des 3 termes suivants à peu près indépendants les uns des autres :
- du nombre de plateaux théoriques N (donc de l’efficacité de la colonne)
- du facteur de séparation \alpha (donc de la « proximité » des pics)
- du facteur de rétention k'(donc des temps de rétention des pics)
Démonstration de la formule de Purnell.
\begin{align}R=2\left( \dfrac{t_B-t_A}{\omega_A +\omega_B} \right) = 2\left(\dfrac{t_B-t_A}{\omega} \right)\end{align}car \omega_A \approx \omega_B = \omega et en posant t_{(A)} =t_r(A) et t_{(B)} =t_r(B)
\begin{align}N_B=\dfrac{16 \cdot {t_{(B)}}^2}{\omega ^2} \qquad \text{d'ou}\qquad \dfrac{1}{\omega}=\dfrac{1}{4}\cdot \sqrt{N_B}\cdot \dfrac{1}{t_{(B)}} \qquad \text{et} \qquad R=\dfrac{1}{4} \cdot \sqrt{N_B} \cdot \dfrac{t_{(B)}-t_{(A)}}{t_{(B)}}\end{align} \begin{align} \text{comme}: \qquad t_{(B)} =t_r(B) = t_m \cdot (1 + k^{\prime}B) \end{align} \begin{align}R&=\dfrac{1}{4}\cdot\sqrt{N_B}\cdot \dfrac{t_{(B)}-t_{(A)}}{t_m(1+K^{\prime}_B)} \qquad \text{en multipliant par} \qquad \dfrac{t_{(B)} - t_m}{t_{(B)} - t_m} \\ \text{On obtient} \qquad R&=\dfrac{1}{4}\cdot\sqrt{N_B}\cdot\dfrac{t_{(B)}-t_{(A)}}{t_m(1+K^{\prime}_B) \cdot\dfrac{t_{(B)}-t_m}{t_{(B)}-t_m}}\\ R&=\dfrac{1}{4}\cdot\sqrt{N_B}\cdot\dfrac{t_{(B)}-t_{(A)}}{t_m(1+K^{\prime}_B) \cdot\dfrac{K^{\prime}_B}{1+K^{\prime}_B}}\\ \text{Or}\qquad \dfrac{t_{(B)}-t_{(A)}}{t_{(B)}-t_m}&=\dfrac{t_{(B)}-t_m}{t_{(B)}-t_m}-\dfrac{t_{(A)}-t_m}{t_{(B)}-t_m}=\left( 1-\dfrac{1}{\alpha}\right) =\dfrac{\alpha-1}{\alpha}\end{align} \begin{align}R=\dfrac{1}{4}\cdot\left(\dfrac{\alpha-1}{\alpha} \right)\cdot\left(\dfrac{K^{\prime}_B}{1 + K^{\prime}_B} \right)\cdot\sqrt{N_B}\end{align}Exercice d’application
Quiz ici
Optimisation des performances d’une colonne
\begin{align} R=\dfrac{1}{4}\cdot\left(\dfrac{\alpha-1}{\alpha} \right)\cdot\left(\dfrac{K^{\prime}_B}{1 + K^{\prime}_B} \right)\cdot\sqrt{N_B} \qquad\text{La formule de Purnell} \end{align}
Paramètres déterminants la performance de la colonne :
- modification du facteur de capacité : diminuer ou augmenter K’ changement de la composition du solvant
- modification du facteur de sélectivité :
- modifier la composition de la phase mobile
- modifier la T° de la colonne
- changer la composition de la phase stationnaire
- augmenter N :
- augmenter L : si L doublée, alors R augmente de \sqrt{2} mais tr augmente
- diminuer H :
- diminuer le diamètre des particules support (diminuer le terme A )
- diminuer le diamètre de la colonne (diminuer le terme C)
- diminuer T°(chromatographie gazeuse CPG) (diminuer le terme B)
- diminuer épaisseur du film liquide(chromatographie gazeuse CPG) (diminuer le terme C)
- diminuer viscosité de la phase mobile ( HPLC) (diminuer le terme C)
- optimiser \mu ( vitesse linéaire de de la phase mobile)
Share this content:
Table des matières