Les concentrations
Définition de la concentration molaire ou molarité
La concentration molaire est une grandeur caractérisant toute solution, elle reflète la proportion d’une espèce chimique dissoute (soluté) par rapport à un solvant. La concentration molaire (C) d’une espèce chimique est le rapport de la quantité ou nombre de moles (n) de cette espèce chimique par le volume (V) de la solution, ce qui se traduit par la formule suivante :
C = \dfrac{n}{V}
- C est en général exprimé en mole par litre (mol/L), d’autres unités sont envisageables (mmol/L, mol/mL etc) mais la mol/L est l’unité la plus courante (la plupart des relations faisant intervenir la concentration molaire nécessitent cette unité).
- n est en mole (mol)
- V est en litre (L)
Remarques
- La notation C est souvent accompagnée d’une indication de l’espèce chimique concernée dont le nom ou la formule peut être mentionné entre parenthèses ou en indice.
- Le volume V utilisé pour calculer une concentration molaire est celui de la solution et non celui du solvant, mais lorsque la quantité de matière est faible on se permet souvent de faire l’approximation que le volume de la solution est le même que celui du solvant.
- Lorsque le terme « concentration » est utilisé sans précision, il fait en général référence à la concentration molaire et non à la concentration massique. De même si la notation « C » est utilisée sans précision alors elle se réfère en général à la concentration molaire et non massique.
Exemple
Si une solution de 100 mL a été obtenue en dissolvant 0,050 mol de glucose dans de l’eau alors :
C (glucose) = \dfrac{0,05}{0,100} = 0,5 mol/L
Influence de la concentration molaire sur une solution
La concentration molaire peut avoir une influence sur l’aspect de la solution:
- si le soluté est une espèce chimique colorée alors la couleur est d’autant plus intense que la concentration de cette espèce est élevée.
- Si l’espèce chimique dissoute à un goût alors celui-si sera d’autant plus « fort » que la concentration est élevée.
- Si l’espèce chimique dissoute est acide alors l’acidité de la solution sera d’autant plus forte (et le pH d’autant plus bas) que la concentration est élevée.
- Inversement, si une espèce chimique est basique alors la basicité d’une solution sera d’autant plus forte (et le pH d’autant plus haut) que la concentration molaire est élevé
- Si l’espèce chimique dissoute est un réactif alors la réaction sera d’autant plus rapide que la concentration est élevée.
Déterminer une concentration molaire
Par le calcul
Si le volume de la solution et la quantité de matière alors la concentration molaire peut être calculée grâce à la relation qui la définie comme le rapport de ces deux grandeurs:
Encadrement par une échelle de teinte
Si l’espèce chimique dissoute est colorée alors il est possible de fournir un encadrement de sa concentration en réalisant une échelle de teinte : la solution de concentration inconnue est comparée à une série de solutions comportant la même espèce chimique à des concentrations connues décroissantes. Si sa teinte est intermédiaire entre deux solutions (plus claire que l’une, mais plus foncée que les autres) alors les concentrations de ces deux solutions fournissent un encadrement de la concentration recherchée.
Concentration molaire et concentration massique
Chacune de ces concentrations reflète la proportion de soluté dissous dans une solution, la première se réfère à la quantité de matière et la deuxième à la masse. Il est possible d’établir une relation entre les deux et d’exprimer l’une en fonction de le l’autre.
Soit :
- C : la concentration molaire d’une espèce chimique dans une solution (en mol/L)
- Cm : la concentration massique de cette espèce chimique dans la même solution (en g/L)
- n : la quantité de matière de cette espèce chimique (en mol)
- m : la masse de l’espèce chimique dans cette solution (en g)
- V : le volume de la solution (en L)
- MM : la masse molaire de l’espèce chimique (en g/mol)
La concentration molaire est définie par la relation suivante:
C = \dfrac{n}{V}
or : n = \dfrac{m}{MM}
donc : C = \dfrac{m}{MM \times V}
or : C_m = \dfrac{m}{V}
donc : C = \dfrac{C_m}{MM}
La concentration molaire d’une espèce chimique correspond au rapport de la concentration massique par la masse molaire de l’espèce chimique
On peut également déduire la concentration massique à partir de la centration molaire grâce à la relation suivante:
C_m = C \times MM
Cette formule indique que la concentration massique est le produit de la concentration molaire par la masse molaire de l’espèce chimique.
Utiliser la concentration molaire pour calculer une quantité de soluté
Lorsqu’on dispose d’une solution de concentration connue il est possible d’exprimer la quantité de matière contenue dans la totalité de la solution ou dans un prélèvement de volume V à partir d’une relation.
Puisque par définition:
C = \dfrac{n}{V}
On obtient la formule suivante : n = C.V
Ce qui signifie que la quantité de matière d’un soluté correspond au produit de sa concentration par le volume de solution.
Utiliser la concentration molaire pour calculer un volume de solution
Pour déterminer le volume à prélever dans une solution pour avoir une quantité de matière donnée on peut adapter les relations précédentes pour obtenir la formules suivante:
V = \dfrac{n}{C}
Concentration molaire et dilution
Par définition la dilution d’une solution aqueuse consiste à lui ajouter du solvant sans modifier la quantité de matière totale qu’elle contient. Puisque la concentration de cette solution est donnée par la relation:
C_m = \dfrac{m}{V}
l’augmentation du terme « V » sans variation de « n »indique que la concentration diminue :
La dilution d’une solution provoque une diminution de la concentration
Par exemple si une solution est diluée en doublant le volume de solvant alors la concentration C2 de cette solution diluée est:
C_2 = \dfrac{n}{2V} = \dfrac{1}{2}\times \dfrac{n}{V} =\dfrac{1}{2}\times C
Doubler le volume solvant revient à diviser la concentration par deux mais on pourrait aussi montrer que multiplier le volume par 3 conduit à diviser la concentration par 3, multiplier le volume par 4 divise la concentration par 4 etc ….
Puisqu’une dilution provoque une baisse de concentration il peut également y avoir:
- un éclaircissement de la teinte (pour une solution colorée)
- un gout (salé, sucrée ou autre) moins prononcé (si le soluté a un goût)
- une baisse de l’acidité (pour une solution acide)
- une baisse de la basicité (pour une solution basique)
Concentration molaire et vaporisation
Une vaporisation conduit à une perte de solvant et s’accompagne d’une diminution du volume de la solution alors que la quantité de matière ne varie pas ( en général le soluté n’est pas vaporisé). Une vaporisation a donc des conséquences inverses de celle d’une dilution:
- la concentration augmente
- la teinte s’assombrit
- le goût s’accentue etc
Concentration molaire et saturation
La concentration molaire que peut posséder une espèce chimique dans un solvant donné est toujours limitée, lorsque cette limite est atteinte on dit que la solution est saturée et la concentration prend une valeur particulière: elle correspond à la solubilité de l’espèce chimique dans le solvant.
Préparation d’une solution ayant une concentration molaire donnée
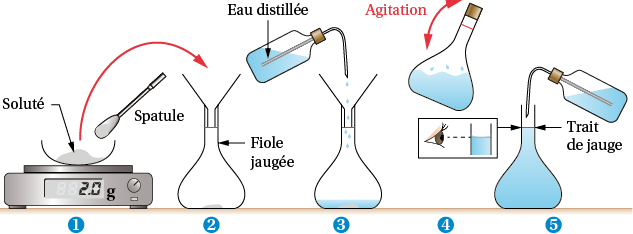
La préparation d’une solution est en général réalisée en suivant ce protocole:
- Chercher une fiole jaugée dont la contenance V correspond au volume de solution que l’on souhaite préparer.
- Déterminer la quantité de matière « n » nécessaire pour obtenir une concentration donnée « C » dans une solution de volume « V »: n = C.V
- Déterminer la masse « m » de soluté à dissoudre : m = M.n (M est la masse molaire du soluté)
- Si le soluté est solide il est prélevé à l’aide d’une spatule et placé dans une coupelle ou directement dans un bécher. Le bécher placé sur une balance et après une tare (remise à zéro) une masse « m » de soluté est ajouté.
- La dissolution commence dans le bécher en ajoutant un volume de solvant largement inférieur à celui de la solution. L’agitation se fait se fait de préférence à l’aide d’un barreau aimanté et d’un agitateur magnétique.
- Après dissolution totale le mélange homogène est transvasé dans la fiole jaugée de volume V. Le bécher est rincé avec le solvant puis versé dans la fiole.
- Le solvant vient compléter la solution, il est ajouté jusqu’à ce que la partie inférieure du ménisque (en surface) coïncide avec le trait de jauge.
- La fiole est ensuite agitée (avec un bouchon) afin d’homogénéiser la solution
- La solution est prête.
Remarque
Si le solvant est liquide il est nécessaire de déterminer le volume V’ à prélever à partir de la masse « m » (déjà calculée) et de la masse volumique
Le pourcentage en masse ou fraction massique
C’est le rapport de la masse de composé X contenu dans un certain volume de solution divisée par la masse de ce volume de solution. Ce rapport est obligatoirement compris entre 0 et 1. On a pris l’habitude de l’exprimer en % pour manipuler des nombres compris entre 0 et 100. Le pourcentage en masse ne présente d’intérêt que lorsque l’on utilise des solutions très concentrées.
Lorsque l’on dispose du volume de la solution, on peut le transformer en masse à l’aide de la densité de la solution.
\begin{align*} p (en \%) = \dfrac{m_x (en\; g)}{m_{solution}(en\; g)} \times 100\end{align*}
Fraction volumique = V/V
\begin{align*}\dfrac{V}{V}(en \%) = \dfrac{V_{solut\acute{e}}}{V_{solution}} \times 100 \end{align*}
V= Volume de soluté (mL)
V= Volume de solution (mL)
La fraction molaire
C’est le rapport de la quantité de matière de X (en mol) contenue dans un certain volume de solution divisée par la somme des quantités de matière de tous les constituants présents dans ce volume de solution . Une fraction molaire est un nombre sans dimension.
Si on note ni la quantité de matière du composé i et xi sa fraction molaire, cette dernière se calculera à partir de la relation ci-dessous.
\begin{align*}x_i = \dfrac{n_i (en\; mol)}{\sum_{i}n_i (en\; mol)} \end{align*}
La fraction molaire est peu utilisée pour exprimer les concentrations des solutés dans des solutions diluées ; en revanche, elle sert pour exprimer la composition des mélanges.
La molalité
Elle correspond à la quantité de matière de soluté pour 1 kg de solvant. Cette unité de concentration n’est que très rarement utilisée.\
\begin{align*} molalit\acute{e} = \dfrac{n(en\; mol)}{m_{solvant}(en\; Kg)} \end{align*}
m solvant = Masse de solvant (Kg) \
n : Nombre de moles de soluté (mol)
La normalité
Concentration normale (ou normalité) est reliée au nombre d’équivalent-grammes de soluté de solution et au type de réaction chimique considérée. Dans le cas des réactions acide-base, l’équivalent-gramme est le nombre de protons échangeables alors que dans les réactions d’oxydo-réductions, il s’agit du nombre d’électrons. La normalité N est donnée par le nombre d’équivalent-grammes de soluté par litre de solution (éq.g/l ou N).
Cette unité de concentration qui a été largement utilisée présente l’inconvénient de dépendre de la réaction par laquelle on va utiliser cette solution. Ainsi, on définit la normalité d’une solution acide dans l’eau comme le nombre de mol d’ion H3O+ susceptible d’être libérés par un litre de solution. De même, la normalité oxydo-réductrice d’une solution correspond au nombre de mol d’électrons susceptibles d’être libérés par un litre de solution : dans ce dernier cas, la normalité dépend de la nature de l’espèce chimique avec laquelle on peut faire réagir la solution.
\begin{align*} Normalit\acute{e} (N) &= \dfrac{\acute{e}q_{solut\acute{e}}}{V_{solution}(en\; L)} \\
\acute{e}q &= \dfrac{m_{solut\acute{e}}}{m-\acute{e}q_{solut\acute{e}}}\end{align*}
N = Normalité (équivalents/L)
V = Volume de solution (L)
msoluté = Masse de soluté (g)
méq = Masse équivalente (g/éq)
Parties par million (ppm)
\begin{align*} ppm = \dfrac{m_{solut\acute{e}}(en\; mg)}{m_{solut\acute{e}}(en\; Kg)} \qquad \qquad 1 ppm = 1 mg/kg = 1 mg/l = 1 \mu g/ml \end{align*}
Parties par billion (ppb)
\begin{align*} ppb = \dfrac{m_{solut\acute{e}}(en\; \mu g)}{m_{solut\acute{e}}(en\; Kg)} \qquad \qquad ppb = 1 \mu g/kg = 1 \mu g/l = 1 ng/ml \end{align*}
Parties par trillion (ppt)
\begin{align*} ppt = \dfrac{m_{solut\acute{e}}(en\; ng)}{m_{solut\acute{e}}(en\; Kg)} \qquad \qquad 1 ppt = 1 ng/kg = 1 ng/l = 1 pg/ml \end{align*}
Share this content:
Table des matières