Électrophorèse
Définition
L’électrophorèse est une méthode de séparation de constituants en solution. Elle est basée sur la différence de migration de particules chargées électriquement, sous l’effet d’un champ électrique.
Elle s’applique aux ions métalliques, aux molécules chargées quelle que soit leur taille: ions ou macromolécules (protéines) ou tout autre composé pouvant être transformé en particules chargées.
Il y a 2 grands types d’électrophorèse:
- Électrophorèse de frontière
- Électrophorèse de zone
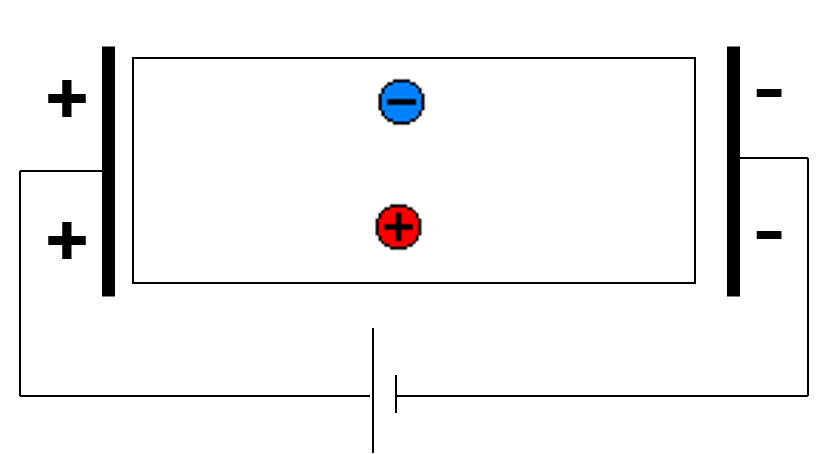
Électrophorèse de frontière
Principe
Elle a été réalisée par \textsc{Tiselius} dans un tube en U de section carrée : la séparation n’est pas totale, mais les frontières qui se forment sont mises en évidence par des méthodes optiques (absorption UV, indice de réfraction, fluorescence…).
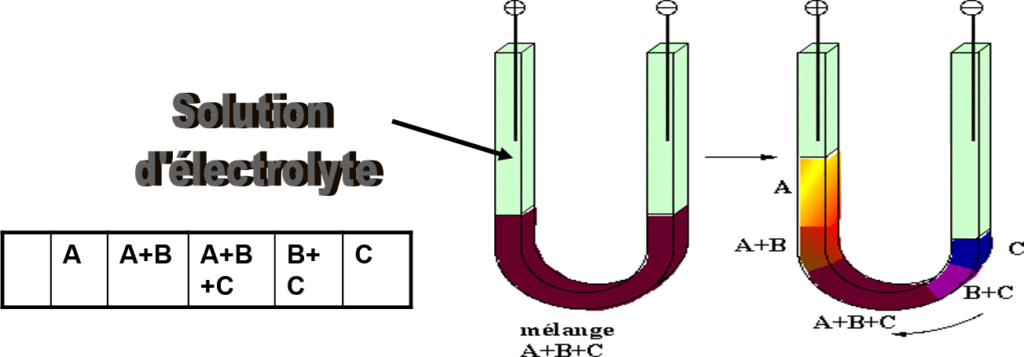
Cette méthode est utilisée en recherche pour mesurer la mobilité électrophorétique et pour vérifier la pureté des protéines.
Mise en oeuvre
On commence par déposer le mélange puis un électrolyte tamponné.
On a 2 électrodes (anode + cathode) auxquelles on impose une différence de potentiel. Les molécules chargées vont migrer vers l’anode ou la cathode.
D’où séparation des composés même si elle n’est pas totale.
Électrophorèse de zone
L’électrophorèse de zone (EZ) ou électrophorèse sur support est la technique électrophorétique la plus utilisée. La phase liquide est stabilisée grâce à l’utilisation d’un support poreux imprégné d’un électrolyte tamponné.
Appareillage:
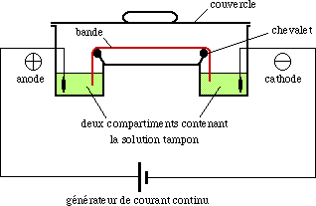
Principe
Selon le pH, et sous l’effet du champ électrique, les composés vont migrer vers l’anode ou la cathode. Il y a séparation des composés et formation de zones.
Les supports doivent être homogènes, poreux et « inertes ». On utilise: papier, l’acétate de cellulose, gel de polyacrylamide, gel d’agarose, gel d’amidon… ).
Aspects théoriques de la migration électrophorétique
L’électrophorèse est basée sur la migration d’une espèce chargée, sous l’influence d’un champ électrique, au sein d’un électrolyte stationnaire.
le contact espèce/électrolyte, forme une double couche électrique.
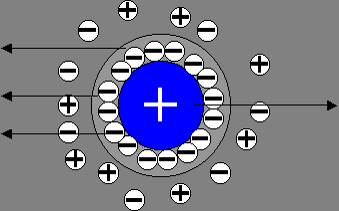
Dans l’électrophorèse classique, la solution peut être considérée comme immobile et c’est l’espèce chargée qui se déplace, on la caractérise par le paramètre mobilité électrophorétique [/latex]\mu[/latex].
Mobilité électrophorétique [/latex]\mu[/latex]
Elle est fonction de la charge, de la géométrie de la particule et de la nature du milieu. Chaque espèce chargée est caractérisée par sa propre [/latex]\mu[/latex].
Forces en jeu
Une particule de charge électrique Q, placée dans un champ électrique E, est soumise à:
Force F
Une force F qui l’entraîne vers l’électrode de signe opposé :
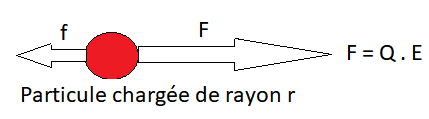
Forces de frottement f
Des forces de frottement f, dues à la viscosité [/latex]\eta[/latex] du milieu, ces forces s’opposent à la migration de la particule, et ce d’autant plus que la particule est grosse (r grand) et que la vitesse de migration (V) est grande :
(1) ![]()
[/latex]\eta[/latex] dépend de la température
Il arrive un moment où ces deux forces s’équilibrent, et la particule se déplace alors à vitesse constante; on peut alors écrire:
(2) ![]()
On définit pour chaque particule sa mobilité [/latex]\mu[/latex], de manière indépendante du champ électrique, par la relation :
(3) 
La mobilité est une caractéristique de chaque particule; il est donc possible d’effectuer une séparation en se basant sur cette propriété.
Remarques:
Les particules se déplacent essentiellement sous l’influence de la charge Q qui dépend de l’ionisation. En effet, le composé doit avoir des groupements ionisés ou ionisables. Les paramètres suivants jouent un rôle important:
- pH de la solution [en milieu acide, ionisation des bases (groupements NH_2); et à pH alcalin ionisation des acides]
- la force ionique : plus elle est élevée, plus les composés sont ionisés.
- formation de complexes qui [/latex]\nearrow[/latex] ou [/latex]\searrow[/latex] l’ionisation.
- La température [/latex]T^\circ[/latex] : quand la [/latex]t^\circ[/latex] [/latex]\nearrow[/latex] l’ionisation [/latex]\nearrow[/latex]
Pour les protéines:
- Point isoionique: il s’agit du pH pour lequel un composé a autant de charges négatives que positives. il y aura autant de COO– que de NH3+.
- Point isoélectrique: pH pour lequel un composé n’a aucune mobilité.
Le point isoionique est toujours défini dans un solvant pur (il n’y a que H^+}), alors que le point isoélectrique dépend de l’environnement (H^+}, Na^+}, Ca^{2+}} … ), donc ils peuvent être sensiblement différents.
Ex: albumine : point isoionique : 5,4
point isoélectrique : 4,4
La différence [pH – pHi] détermine le signe de la charge Q d’une protéine :
- si pH > pHi charge nette – (anion) migration vers l’anode
- si pH < pHi charge nette + (cation) migration vers la cathode
- si pH = pHi charge nette nulle pas de migration
Plus cette différence est grande en valeur absolue, plus la charge est importante.
Mise en œuvre de l’électrophorèse de zone
Appareillage
On utilise :
- un générateur de tension continue : Une différence de potentiel « DDP » de 10 à 3000 volts (souvent 100 – 200 V)
- 2 bacs
- Solution électrolytique support
Solution électrolytique
Important de contrôler le pH: souvent en milieu alcalin (pH 8); séparation des protéines (COO^-} migre vers anode)
Support
- Acétate de cellulose : 20 \% des électrophorèses aujourd’hui.
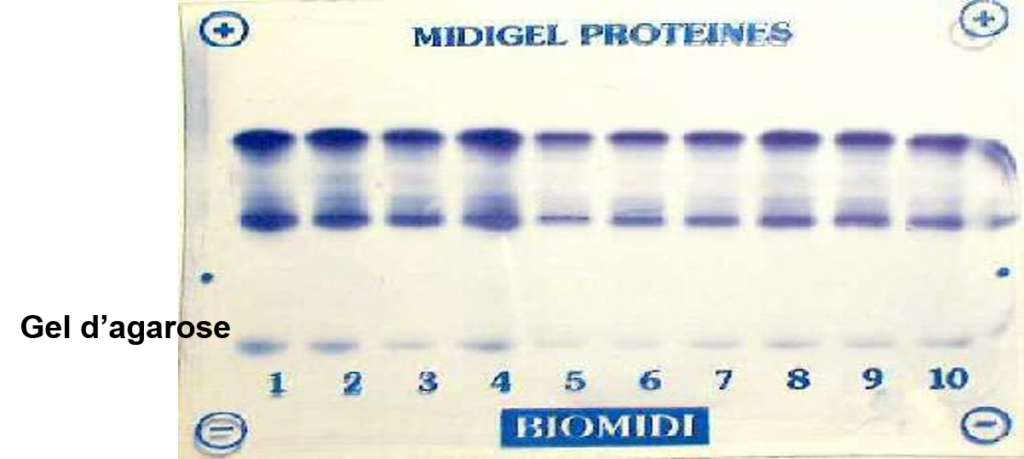
- Gel d’agarose le plus utilisé
- Gel d’amidon fort pouvoir séparateur
- Gel de polyacrylamide
Mode opératoire
On imprègne le support par la solution électrolytique, puis on dépose quelques microlitres de l’échantillon à analyser.
Révélation
On utilise un colorant ou une réaction d’immunorévélation
Intégration
On mesure la surface de chacune des zones et son \%.
Application
Méthode applicable à toute molécule ionisée ou ionisable. Surtout pour les protéines sériques, LCR, urine.
Pour les séparer: agarose ou acétate de cellulose
Colorants
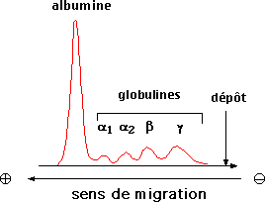
Ex. : sérum sanguin révélation par le rouge Ponceau ou le noir amide séparation en 5 zones albumine, [/latex]\alpha_1, \alpha_2, \beta, \gamma[/latex] globulines.
Par intégration, on obtient les pourcentages de chaque composé.
Électrophorèse capillaire de zone: ECZ
Principe
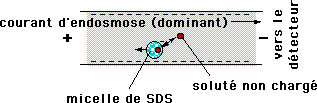
- Séparer des espèces ioniques selon leur charge
- Séparer des espèces non chargées à l’aide de micelles
Technique
- Capillaire de silice
- Voltages élevés (15 -30 kV).
- Détection directement sur capillaire par absorption UV, fluorimétrie ou conductimétrie
- Sensibilité particulièrement élevée (quelques nanolitres de l’échantillon).
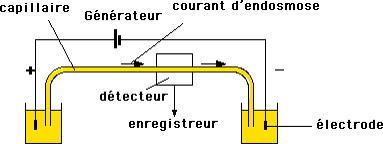
Appareillage
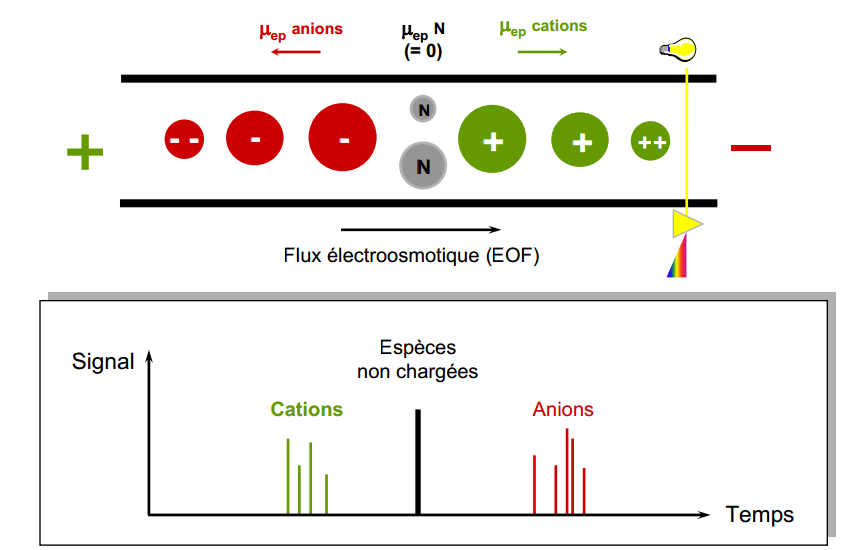
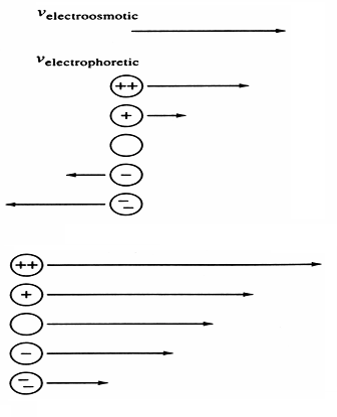
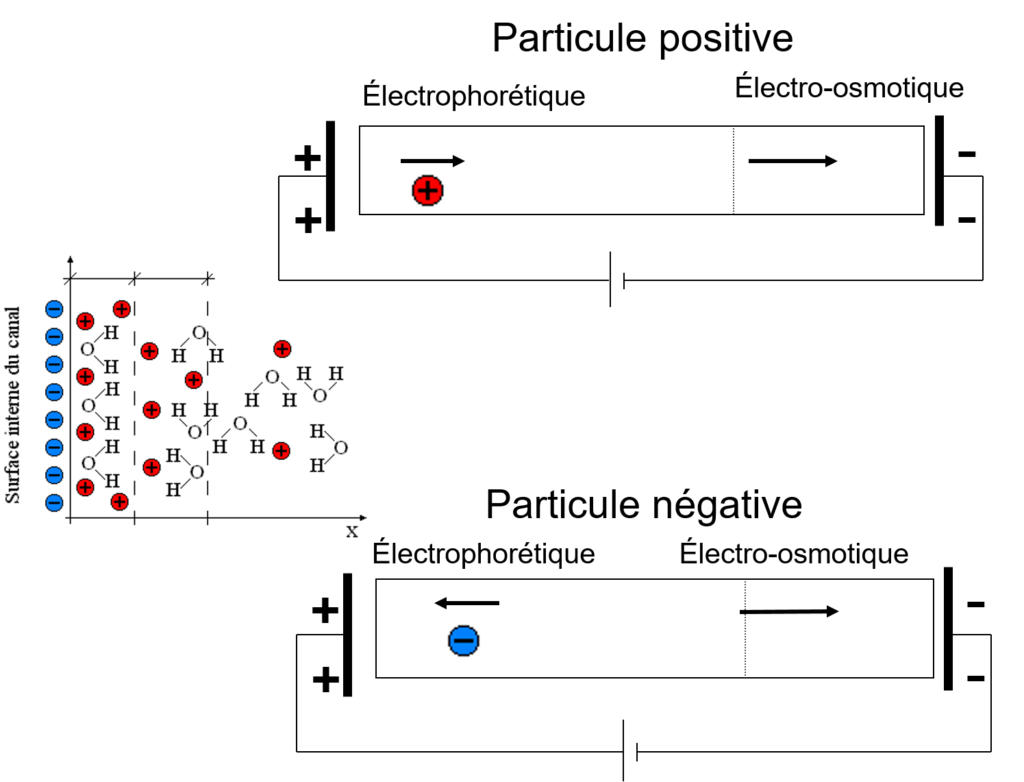
On définit les vitesses suivantes:
- électroosmotique: vers (-): [/latex]V_{eo} = \mu_{eo}\cdot E}[/latex]
- électrophorétique: vers (+): [/latex]V_{ep} = \mu_{ep}\cdot E}[/latex]

- La vitesse électrosmotique est la même pour toutes les espèces
- La vitesse électrophorétique dépend de la charge de l’espèce pour des espèces sphériques de même diamètre.
- les espèces non chargées se déplace à la vitesse électrosmotique
- Les espèces chargées se déplace à une vitesse totale:
(4) ![]()
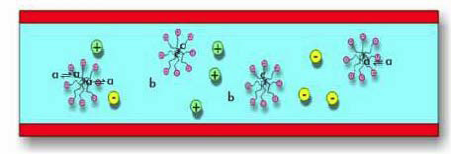
Électrophorèse capillaire micellaire
Les substances les plus apolaires sont davantage « retenues » et la séparation obtenue s’apparente à celle de la HPLC en phase inverse.
Présente un domaine d’application large:
- Biomédicale (ADN, Protéines, peptides )
- molécules organiques chargées ou neutres ,Masse Moléculaire faibles ,
- petits anions minéraux et organiques (Cl , Br ,SO4…)
- Séparation des espèces + (cations) et – (anions). Dans l’industrie pharmaceutique :
- peu utiliser en contrôle de routine (en recherche +++)
- Recherche des impuretés → méthode complémentaire de la CLHP car principes différents
- analyse de petits ions → vérification des impuretés minérales ( Inscrite dans la pharmacopée Européenne)
Share this content:
Table des matières