La compléxonométrie
Utilisation des complexons
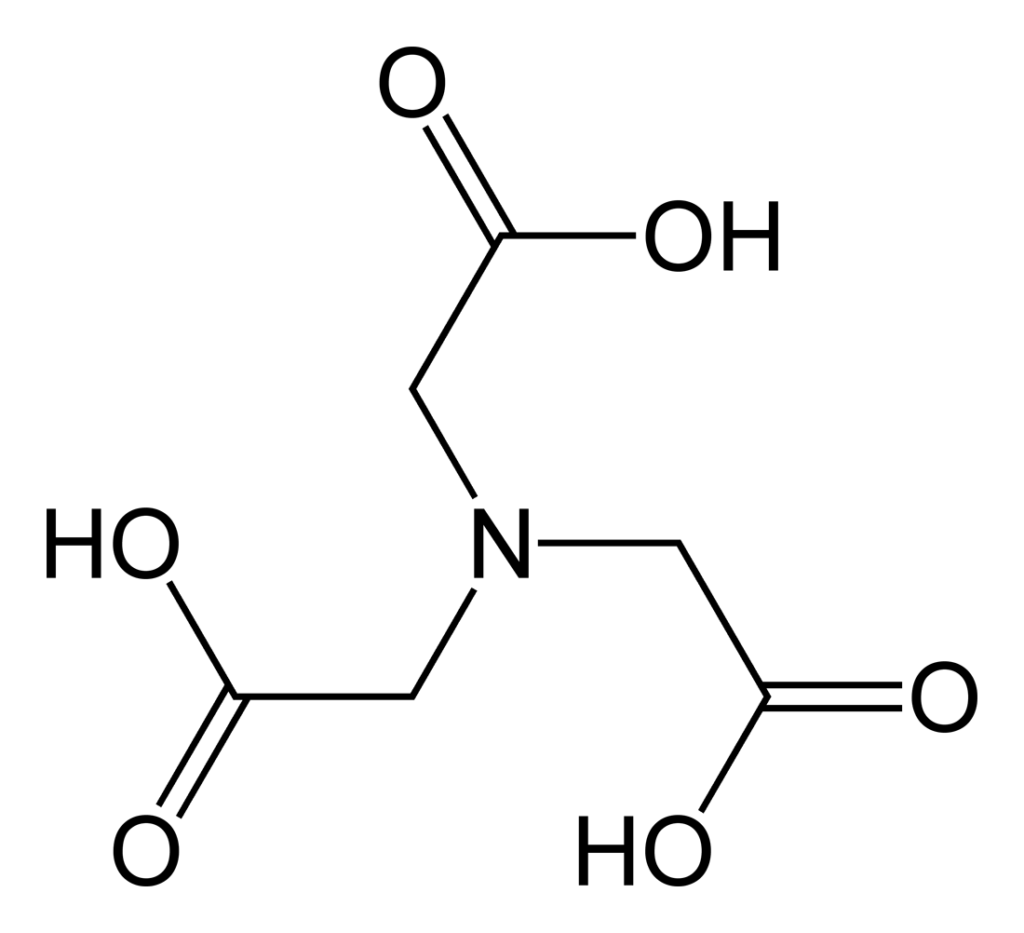
- Complexon I: Acide nitrilo-triacétique
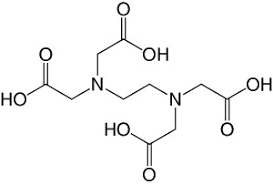
- Complexon II: Éthylène diaminetétra-acétique acide (EDTA: H4Y )
- Complexon III: Sel disodique de l’éthylènediamine tétra-acétique (EDTA: Na2H2Y )
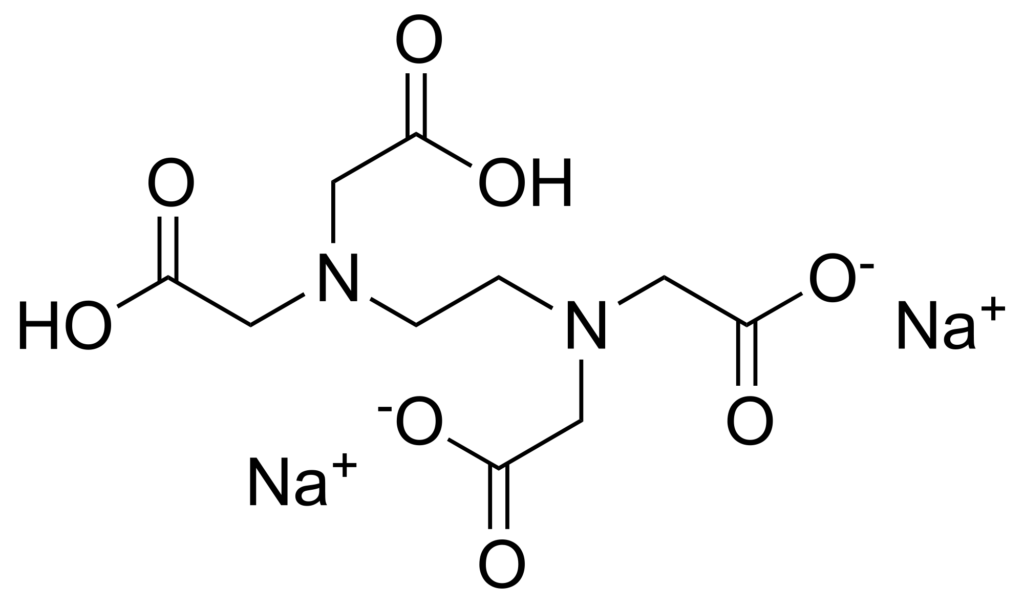
On symbolise toujours le ligand EDTA par Y4-
La réaction de complexation avec Y4- est une réaction avec un coefficient stœchiométrique (1 à 1)
Important : toujours
1 ion-gramme Y4- → 1 ion-gramme métallique Mn+
(1) ![]()
Expression des titres en molarité
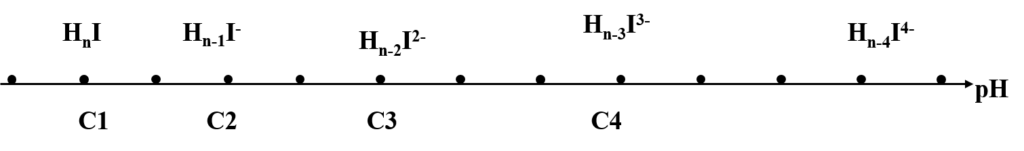
Prédominance des espèces de H4Y en fonction du pH
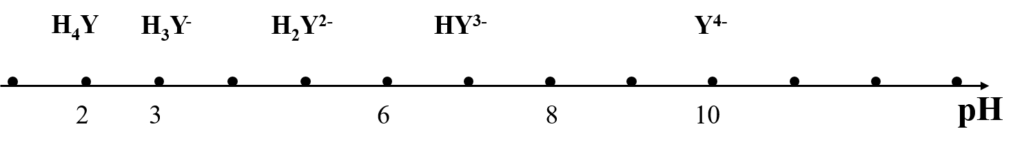
Les espèces de dissociation sont en fonction de la variation du pH
La titration se fait en milieu neutre ou basique
Malgré la stabilité des complexes (M-EDTA) il y a dissociation en présence d’acide à cause de la protonation de Y4-
(2) ![]()
La formation de H+ fait diminuer le pH titration peut cesser
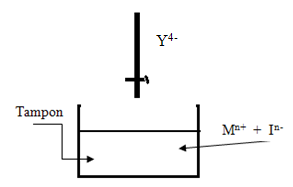
D’où nécessité de l’emploi d’un tampon qui permet :
- éviter L’augmentation de H+ .
- éviter la précipitation de
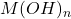
Exemple tampons : le couple NH4+ / NH3 ; couple ACOO–/ ACOOH .
Courbe de titrage
Seule la réaction de complexation intervient
(3) ![]()
La constante de stabilité:
![]()
État | X=[Y | [M | [Y | [MY |
0 | C0 | 0 | 0 | |
a) | 0<X<1 | (1-X) | #0 | |
b) | X=1 | # 0 | # 0 | |
c) | X>1 | # 0 | (X-1) | |
- Avant le point équivalent:
- X = 0 →

- 0 < X < 1 →
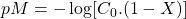 Ks n’intervient pas
Ks n’intervient pas
- X = 0 →
- Au point équivalent:
(4)
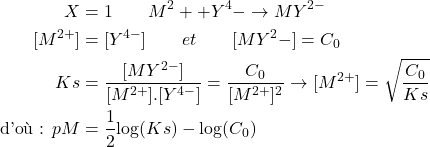
- Après le point équivalent :
(5)
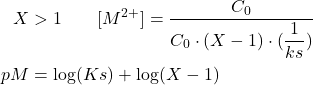
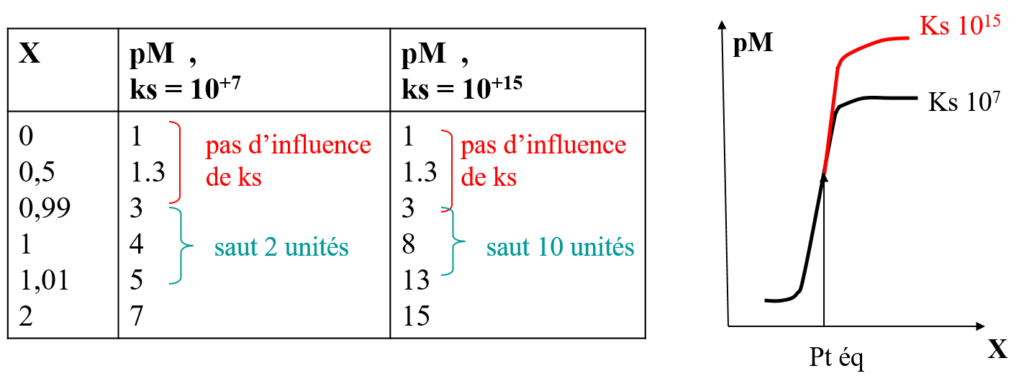
Remarques :
Pour Ks = 107 saut est de 2 unités : Saut min à Ks min
La Mise en évidence du point équivalent se fait par:
- Potentiométrie (électrode indicatrice de Mn+ à doser)
- Indicateurs colorés.
Indicateurs métallochromiques
Définition : ce sont des composés qui changent de couleur lorsqu’ils sont en présence d’ions métalliques ou que ces ions disparaissent par combinaison avec le complexon (ligand).
Se sont des bases de Lewis (indicateurs I: donneurs d’électrons) : Capables de donner des complexes avec les Mn+ et de réagir avec les H+
Le changement de couleur intervient lorsque un ou plusieurs H+ sont remplacés par des ions Mn+ .
Chaque forme protonée a 1 couleur différent de l’autre .
Si il existe du M2+ en contact avec In– il peut se former un complexe MI(n-2)-
Le couple ![]() donc on aura 2 couleurs
donc on aura 2 couleurs
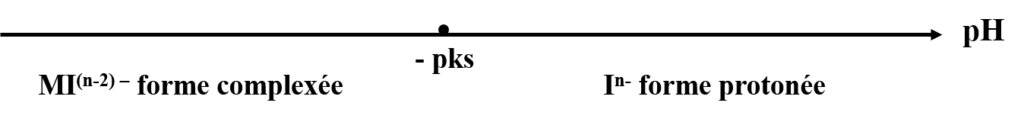
La couleur de la forme protonée est différent de celle de la forme complexée.
(6) 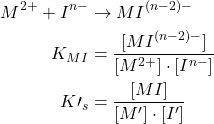
Il faut que ![]()
Si non on aura complexation de ![]() avec
avec ![]() .
.
Mécanisme de virage
Basé sur la forme MI et In- libre
(7) ![]()
Pour des raisons de commodité on écrit :
d’où : ![]()
On définit pM de transition ![]() entre la forme libre et la forme complexée lorsque:
entre la forme libre et la forme complexée lorsque:
([I] = [MI]) Virage ![]()
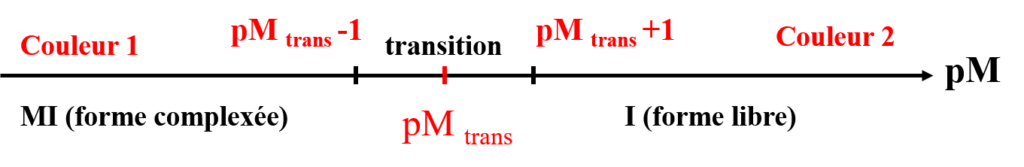
Classification
Souvent la couleur du complexe est celle de l’anion libre et le changement de la coloration intervient alors lorsqu’un ou plusieurs protons remplacent Mn+
Il est possible de les classer
- Colorants à anion coloré : Azoïques, phtaléines dérivés du triphénylméthane ou de l’anthraquinone ou des dérivés phénoliques.
- Indicateur à anion non coloré : ce n’est qu’on réagissant avec le cation métallique qu’il y a coloration ex. : SCN– → [FeSCN]2+ rouge] [/latex] , Sulfosalicylate → Complexe colorés
Dérivés azoïques (–N=N–)
- Noir Eriochrome T :(NET) Mg2+ (Coloration Indicateur libre : Bleu vert Ind Complexe: rouge)
- Calcon (calcone)
- Patton et Reeder Ca2+
- Zincon Zn2+
- P.A.N. : (pyridyl azo naphtol)
Dérivés non azoïques
Murexide (acide isopurpurique) riche en N et C=O spécifique au Ca2+ même en présence Mg2+ , Sn2+ , Ba2+
Coloration Ind : Bleu violet Complexe rouge
Dérivés des phtaléines : (indicateur de protométrie)
Indicateurs de complexation par greffe de
sur une phtaléine
- Calceine Ca2+ (dosage de Ca dans le sérum) dérivée de la fluorescéine : Virage basé sur la fluorescence
- Xylénol orange Zn2+,Pb2+
- Aluminon Al3+
Techniques de complexation
Dosage direct : plusieurs conditions
- Mn+ ne précipite pas au pH fixé.
- utiliser un indicateur virant au pH attendu.
- Il faut que
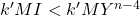
- avant le virage coloration du Complexe MI
- au point équivalent on a : Complexe MI et Complexe MY
- après le point équivalent : l’excès de Y4- déplace l’indicateur du Complexe MI → changement de coloration (I : libre)
Exemples :
| Dosage des cations | pH | Indicateur |
| Ca2+ | 12 | Calceine |
| Mg2+ | 10 | NET |
| Zn2+ , Pb2+, Bi3+ | Xylène orange | |
| Al3+ | 10 | Dithizone |
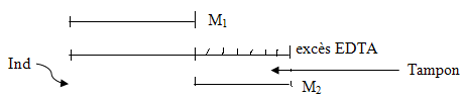
Dosage en retour
Utilisé dans deux cas
- pH
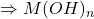
- pas d’indicateur
-
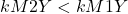 choix de M2
choix de M2 - Si problème de précipitation de M1 :
- fixer le pH
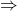 Complexe M1Y est formé
Complexe M1Y est formé - ajouter tampon M1 ne précipite pas
- fixer le pH
Exemple : M1 = Al3+ , M2 = Pb2+ et Indicateur = dithizone
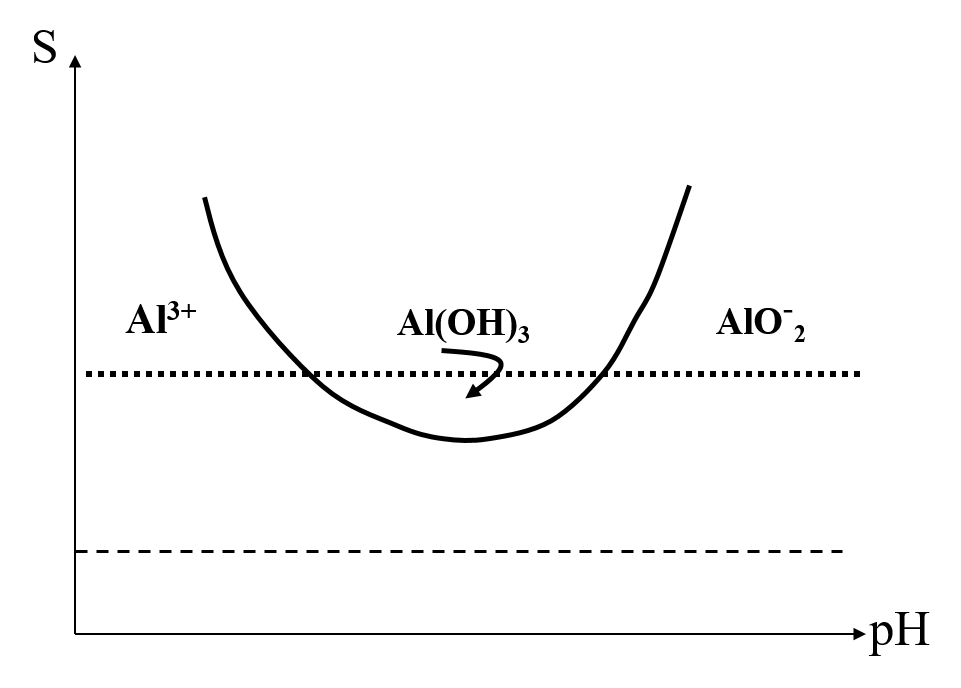
Méthodes par remplacement
(8) ![]()
Ensuite M12+ est dosé par Y4-
Le dosage de M est remplacé par le dosage de ![]()
Il faut que : ![]()
Exemple :
(9) ![]()
Ensuite Mg2+ est dosé par Y4- à pH = 10 et en présence du NET.
Ceci quand il n y a pas d’indicateur pour Cd2+
Méthodes sélectives : ( doser 1 cation dans 1 mélange de cations)
par complexation
- On met CN– en excès en présence des cations.
- On dose Ca2+ qui reste libre par l’EDTA Y4-
par précipitation
cas de Mg2+ et Ca2+ à doser (dureté de l’eau)
- dosage de Mg2+ + Ca2+ à pH 10 en présence du NET
- à pH 12,3 :
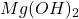 précipite Ca2+ en solution est dosé par Y4- en présence du murexide
précipite Ca2+ en solution est dosé par Y4- en présence du murexide - à pH 10 : on ajoute de l’oxalate
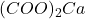 précipite et Mg2+ en solution est dosé par Y4- en présence du NET.
précipite et Mg2+ en solution est dosé par Y4- en présence du NET.
par action du pH
Pour doser Fe3+ dans un mélange de Fe3+ et Ca2+ par exemple.
On ajuste le pH jusqu’on arrive à former seulement le complexe le plus stable.
Diminution de Ks de Ca2+ donc pas de Complexation avec Ca2+
Ks de Fe3+ reste élevée à doser seul
Méthodes protométriques
![]() A doser par OH– Rouge de méthyle
A doser par OH– Rouge de méthyle
Exemple
Formation de Complexe citrique avec Cu2+ et libération de H+
1 litre de OH– à 0,1N ↔ 1/20 M2+
Solutions titrées
On part du complexon II : étalon primaire mais peu soluble en milieu aqueux.
Le complexon III soluble dans l’eau : leur concentration habituelle varie de 10-1 à 10-3 M
On prépare des solutions de 0,1M qu’on dilue éventuellement au moment de l’emploi. Le complexon III existe pur dans le commerce et pourrait être utilisé comme étalon I à deux conditions :
- La première porte sur le solvant (qualité de l’eau) pas de traces d’ions métalliques si non consommation du réactif qui conduit à une diminution de concentration.
- La deuxième porte sur le flacon de conservation : en polyéthylène et non en verre.
Pour ces raisons il faut étalonner les solutions d’EDTA à l’aide de sels métalliques très purs : Zn2+, Ca2+
- CaCO3 pur desséché au préalable puis traiter avec HCl.
- CaCl2 pur desséché au préalable.
- Zn : lavé à HCl pour dissoudre l’oxyde ensuite lavé par : eau, alcool, éther puis séché.
Share this content:
Table des matières

