Cerimétrie
Aspects généraux
Le Cérium IV (sulfate de cérium ou ![]() est un puissant oxydant.
est un puissant oxydant.
Il ne peut être utilisé qu’en solution acide, de préférence à 0,5M ou plus. Dans les solution neutres, il se forme un précipité d’hydroxyde de cérium IV.
(1) ![]()
La solution de cérium IV est de couleur jaune vif et l’on peut détecter le point d’équivalence sans avoir recourt à un indicateur lorsque la solution n’est pas trop diluée.
Cependant il faut alors effectuer une correction d’essai blanc
Préférable d’ajouter un indicateur approprié.
En tant qu’agent oxydant, le sulfate de cérium IV présente les avantages suivants :
- Solutions remarquablement stables pendant de longues périodes. Elles n’ont pas besoin d’être protégée de la lumière et peuvent même être chauffée sans changement appréciable de leur titre,
- Le sulfate de cérium peut être utilisé pour doser des substance réductrices en présence d’acide chlorhydrique concentré. (sauf si le dosage nécessite un fort chauffage),
Le potentiel redox du couple ![]() dépend fortement de la nature et de la concentration de l’acide présent comme l’indiquent les valeurs du potentiel normal apparent :
dépend fortement de la nature et de la concentration de l’acide présent comme l’indiquent les valeurs du potentiel normal apparent :
![]() ne réagissent pas.
ne réagissent pas. ![]()
NB: Précipitation à pH 1,5; utilisation limité à pH < 1,5
| Acide perchlorique (N) | 1,70 V |
| Acide acétique | 1,61 V |
| Acide sulfurique (N) | 1,44 V |
| Acide chlorhydrique (N) | 1,28 V |
Préparation des solutions titrées
Préparation en milieu acide:
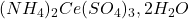 : Trisulfatocerate d’ammonium.
: Trisulfatocerate d’ammonium.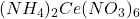 : Hexanitratocerate d’ammonium.
: Hexanitratocerate d’ammonium.
La solution de ![]() peut être préparée par dissolution du sulfate de cérium IV en milieu acide
peut être préparée par dissolution du sulfate de cérium IV en milieu acide ![]() (ou du sel d’ammonium plus soluble
(ou du sel d’ammonium plus soluble ![]() dans de l’acide sulfurique dilué 0,5 à 1 M.
dans de l’acide sulfurique dilué 0,5 à 1 M.
Il existe également un sel nitrate d’ammonium et de cérium ![]() pouvant être utilisé à condition d’éliminer les nitrates par évaporation avec l’acide sulfurique.
pouvant être utilisé à condition d’éliminer les nitrates par évaporation avec l’acide sulfurique.
A partir du nitrate d’ammonium et de cérium
Exemple de solution 0,1M :
- Peser 55,0g de
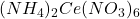
- Ajouter 48 ml de
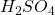 concentré est évaporer à sec.
concentré est évaporer à sec. - Dissoudre le sulfate de cérium résultant dans
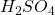 1 M et ajuster le volume à 1 L dans une fiole jaugée (bien agiter).
1 M et ajuster le volume à 1 L dans une fiole jaugée (bien agiter).
A partir du sulfate cérium
Exemple de solution 0,1M :
- Peser 34 g de
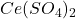 pur
pur - Ajouter 56 ml d’acide sulfurique concentrer et l’eau petit à petit en chauffant doucement jusqu’à dissolution totale.
- Ajuster le volume à 1 L dans une fiole jaugée.
Étalonnage
Par le fer (Fe2+)
Même chose que pour MnO4– (Voir manganimétrie)
(2) ![]()
Par l’anhydride arsénieux (As2O3)
Même chose que MnO4– (Voir manganimétrie)
- L’anhydride arsénieux est pesé précisément,
- Séché puis dissout dans NaOH à chaud.
- La solution est ré-acidifiée par l’acide sulfurique est titrée par la solution à étalonner de sulfate de cérium en présence d’un indicateur approprié : acide N-phényl anthranilique ou ferroïne.
(3) ![]()
Par l’oxalate de sodium :
L’étalonnage nécessite un chauffage. Le dosage est fait d’une manière indirecte.
Le cérium IV est ajouté en excès puis dosé en retour, après refroidissement de la solution par une solution titrée de Fer II.
Le dosage direct est possible par potentiomètrie.
- Une masse exacte d’oxalate est pesée pour l’étalonnage (
 0,2g), dissoute dans l’acide sulfurique
0,2g), dissoute dans l’acide sulfurique - Chauffée à 60°C avant d’ajouter 30 ml de la solution de cérium IV.
- Le dosage en retour avec le fer II est réalisé en présence de ferroïne après refroidissement de la solution.
Applications
Les mêmes choses que le permanganate [katex] MnO_4^-[/katex].
Pratiquement tous les dosages réalisés avec le dichromate de potassium et beaucoup de ceux réalisés avec le permanganate de potassium sont possibles avec le cérium IV.
Des indicateurs appropriés sont disponibles pour ces dosages.
Quand une grande précision n’est pas requise, la coloration jaune pale du sulfate de cérium lui même peut être utilisée.
[katex] Ce^{4+} oxyde Fe(CN)_6^{4-}, SO_3^{2-}, C_2O_4^{2-}, H_2O_2 \cdots [/katex]
Sels ferreux :
Dosage: (Pharmacopée européenne 8.2)
Dissolvez, en chauffant légèrement, 0,150 g de fumarate ferreux dans 7,5 mL d’acide sulfurique dilué R. Refroidissez et ajoutez 25 mL d’eau R. Titrez immédiatement par le sulfate de cérium 0,1 M en présence de 0,1 mL de ferroïne R jusqu’à virage de l’orange au vert-bleu pâle.
1 mL de sulfate de cérium 0,1 M correspond à 16,99 mg de C4H2FeO4.
Autres exemples
- Dosage de l’hydroquinone
- Dosage de la ménadione (vitamine K3)
- Dosage de la vitamine E
- Dosage de l’etamsylate
- Dosage du paracétamol
Avantages:
- Solution stable, supportent la lumière par KMnO4
- Titrage en milieu HCl (pas de problème)
- Solution moins colorée, lecture dans la burette plus facile, par contre il faut opérer avec un indicateur (Ortho-phénantroline [katex]E^\circ [/katex] grand ou ICl dans le chloroforme)
Share this content:
Table des matières

