Protométrie en solution aqueuse
Principe
S’applique aux acides et bases minéraux (MP).
Quelques exemples de substances d’intérêt pharmaceutique : acide citrique, Li2CO3 , aspirine …
- Réaction de neutralisation : équivalent à équivalent
- l’équivalent: masse d’acide cédant 1 ion gramme de
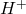 (1mole d’ion hydrogène). ou la quantité de base captant 1
(1mole d’ion hydrogène). ou la quantité de base captant 1 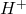
- Réaction :
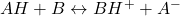
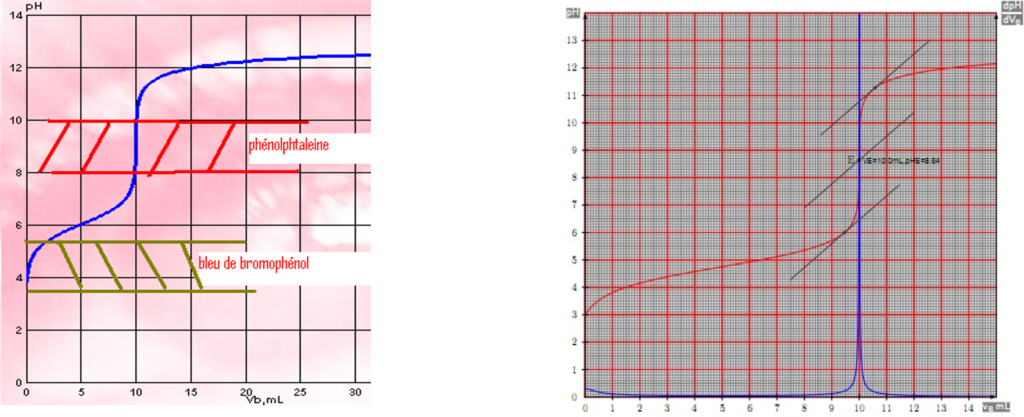
Courbe pH = f(vol. réactif) a une allure log.
Point équivalent = point d’inflexion
pH point équivalent. dépend du sel ![]() formé
formé
pH0 dépend de la concentration de l’échantillon.
pHf (après le point équivalent) dépend de l’excès de réactif
Saut de pH important. (solutions concentrées)
Pente de la courbe élevée avec des antagonistes forts
Réactifs et solutions titrées
Solutions étalons (standards)
Étalon primaire
préparé par pesée exacte
Conditions:
- Solution stable
- Composition définie
- Pureté > 99,9% (MT 10-5)
- Masse molaire (Mr) élevée (précision); pesée exacte (balance de précision)
- Pas de dégradation à la température de séchage.
Étalon secondaire
La solution ne constitue pas un étalon primaire : (difficile à peser, Hydroscopie …).
On prépare une solution par pesée et on effectue une Réaction de dosage pour déterminer le titre exact après sa préparation.
Si la solution est stable et se conserve, elle correspond à un étalon secondaire
Dosage des solutions acides
Sont dosés des :
- Acides forts
- Acides faibles
- Sels d’acide fort et de bases faible
Solutions titrées = solution aqueuse de Base forte
Risque d’altération par CO2 de l’air (carbonatation)
- Si solution carbonatée; éliminer les carbonates ( CO32- )
- Si préparation; éliminer CO2dans l’eau distillée par ébullition
Hydroxyde de Na: NaOH; Mr = 40,01 = équivalent.
- Titre réel peut être diminué (carbonatation) lors de sa préparation ou sa conservation;
- être sur qu’il ne s’agit pas d’une soude carbonatée:
(1)
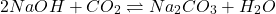
- Na2CO3 précipite en solution concentrée d’où la préparation de solution de titre > 44g/50ml (volontaire) qui entraîne la précipitation de Na2CO3
- Filtrer; Compléter à 1 litre (eau bouillie).
Remarque:
- Difficultés de conservation: d’où préparer des solutions concentrées, qui ne sont diluées qu’au moment de leur utilisation.
- La sol concentrée se décarbonate d’elle-même par précipitation de Na2CO3 in situ.
- NaOH ne constitue pas un étalon 1aire
- Conserver à l’abri de l’air : (garde de chaux)
- Flaconnage: éviter les rodages d’où bouchon à vis
Étalons pour les bases
Les solutions alcalines sont titrées contre des étalons acides
- Acide benzoïque :
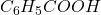 l’équivalent = M =122,12 g
l’équivalent = M =122,12 g - Acide succinique:
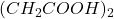 l’équivalent = M/2 = 59,09 g
l’équivalent = M/2 = 59,09 g - Phtalate acide de K(monohydrgénophtalate de K): l’équivalent = Mr =204,22 g
Dosage des bases
concerne toutes molécules capables d’accepter le H+ : Base Forte, Base faible et sel de Base Forte et Acide faible.
Solutions titrées (acides Forts)
H2SO4 : l’équivalent = Mr/2 = 49,05; commerce 36N, d=1,835
- Vol (à prélever pour 1litre
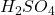 N = (m/d) = 27,7 ml ou (1000/36)
N = (m/d) = 27,7 ml ou (1000/36)  28 ml
28 ml - Compléter avec
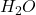 à 1l, agitation
à 1l, agitation - homogénéiser car densité élevée (fiole) tenir compte pureté
NB: Risque d’explosion?
Étalonnage des acides
étalonnés contre des étalons basiques
(sel d’Acide faible et Base Forte)
Carbonate neutre de Na: Na2CO3 anhydre
l’équivalent = M/2 = 53,00 g
![]() en présence de
en présence de ![]() + eau
+ eau
![]()
(2) 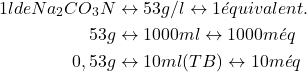
Il faut peser 530 mg exact (dosage directe 1 fois)
ou 5,3g (fiole de 100 ml) ![]() 100 milliéquivalent
100 milliéquivalent
(4 à 5 fois PE 10 ml)
Applications À PMA
Appréciation du point équivalent:
- Indicateur de pH; zone virage
 ; formes acide et base de couleurs différentes; Choix de l’indicateur en fonction du pH au point équivalent.
; formes acide et base de couleurs différentes; Choix de l’indicateur en fonction du pH au point équivalent. - Détection potentiométrique (optique, spectro …)
Quand ? :
- Milieu réactionnel coloré
- Plusieurs points équivalents
- Pas d’indicateur approprié
Dosage des Acides Forts : H2SO4, HCl, H3PO4 …0,1N
ex: mélange (HCl, H3PO4) / NaOH (t); Volume réactif ?
- À pH 4,7: V1 NaOH neutralise HCl et la 1ère acidité de H3PO4, Indicateur: Hélianthine: pH < 3,1 (Rouge), pH > 4,4 (Jaune)
(3)
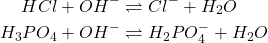
- À pH 9,8: V2 NaOH neutralise la 2ème acidité de H3PO4, Indicateur: Phénophtaléine: pH<8 (incolore), pH>10 (Rouge)
(4)
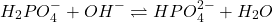
(5) 
Remarque :
3ème acidité très faible non dosable car peu de variation de pH au cours du dosage.
Dosage des Acides faibles (borique, tartrique, citrique..)
(6) ![]()
Mr = 61,83; Af, peu dissocié ![]() variation très faible de pH
variation très faible de pH
NB: H3BO3 réagit avec les polyols
Complexe a un caractère monoacide
pKa = 4; équivalent = Mr; Indicateur (Phénophtaléine)

- (1) dosage en absence de polyol
- (2) et (3) dosage en présence de polyol
Dosage des sels d’ NH4+ (à l’état de NH3 )
distiller (à ébullition) l’échantillon avec un excès OH– (concentré)
(7) ![]()
1 litre de OH– (t) ↔ t M en NH4Cl
↔ t M/2 en (NH4)2SO4
NH4+
OH- (concentré)
NH3
H3O+ excès V1t1
OH- t V2t2
![]() : nombre d’équivalent. d’
: nombre d’équivalent. d’ ![]() ayant réagi avec
ayant réagi avec ![]()
![]()
- Ballon col rodé + chauffe ballon
- Tube Delattre
- Tube réfrigérateur (eau de refroidissement)
- Récupérer
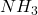 dans un erlen. contenant
dans un erlen. contenant 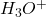 titré
titré - Doser l’excès de
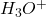 / Base titrée
/ Base titrée
pH des solutions et titrage
Exemple de calcul de pH d’acide fort
\begin{align}
AH + H_2O &\rightarrow A^- + H_3O^+\\
K_i &= [H_3O^+] \cdot [OH^-]\\
[H_3O^+] &= [OH^-] + [A-]\\
[A^-] &= C\\
[H_3O^+] &= \dfrac{K_i}{[H_3O^+]} + [A^-]
\end{align}
Acide pas très dilué : ![]()
Acide très dilué : ![]()
Exemple de calcul de pH de base forte
(8) 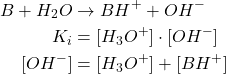
Base trés diluée :
(9) ![]()
Base pas très diluée :
(10) 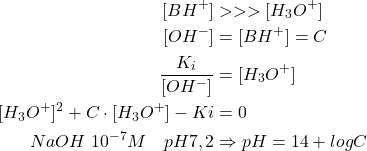
Tableau récapitulatif : Calcul de pH
*** QuickLaTeX cannot compile formula:
\begin{table} \begin{tabular}{|m{4cm}|m{5cm}|m{7cm}|} \hline &Réaction chimique & Calcul de pH \\ \hline Acide faible &AH + H_2O \rightleftharpoons A^- + H_3O^+ & \dfrac{1}{2} pka - \dfrac{1}{2} \log C \\ \hline Base faible & B + H_2O \rightleftharpoons BH^+ + OH^-&7 + \dfrac{1}{2} pka + \dfrac{1}{2} \log C \\ \hline Polyacide & AH_2 + H_2O \rightleftharpoons AH^- + H_3O^+\par AH^- + H_2O \rightleftharpoons A^{2-} + H_3O^+& \dfrac{1}{2} pka_1 - \dfrac{1}{2} \log C\\ \hline Polybase & & 7 + \dfrac{1}{2} pka_1 + \dfrac{1}{2} \log C\\ \hline mélange d'acides faibles & A_1H + H_2O \rightleftharpoons A_1^- + H_3O^+ A_2H + H_2O \rightleftharpoons A_2^- + H_3O^+& - \dfrac{1}{2} \log (ka_1 \cdot C_1 + ka_2 \cdot C_2) \\ \hline mélange de bases faibles & B_1 + H_2O \rightleftharpoons B_1H^+ + OH^-\par B_2 +H_2O \rightleftharpoons B_2H^+ + OH^- & \dfrac{1}{[{H_3O^+}] = \sqrt{\dfrac{C_1}{k_i \cdot ka_1} + \dfrac{C_2}{k_i \cdot ka_2}} \\ \hline du mélange de deux systèmes acide-bases &Acide_1 \rightleftharpoons base_1 + H^+\par Acide_2 \rightleftharpoons base_2 + H^+ & \dfrac{1}{2} pka_1 + pka_2 + \log(\dfrac{base_1}{acide_1} \cdot \dfrac{base_2}{acide_2}) \\ \hline Ampholyte & AH^- + H_2O \rightleftharpoons A^2- + H_3O^+\par AH^- + H_2O \rightleftharpoons AH^- + H_3O^+ & \dfrac{1}{2} (pka_1 + pka_2)\\ \hline \end{tabular} \end{table}
*** Error message:
Not in outer par mode.
leading text: $ \begin{table} \begin
Undefined control sequence \@currbox.
leading text: $ \begin{table} \begin
Missing number, treated as zero.
leading text: $ \begin{table} \begin
Illegal character in array arg.
leading text: ... \begin{tabular}{|m{4cm}|m{5cm}|m{7cm}|}
Illegal character in array arg.
leading text: ... \begin{tabular}{|m{4cm}|m{5cm}|m{7cm}|}
Illegal character in array arg.
leading text: ... \begin{tabular}{|m{4cm}|m{5cm}|m{7cm}|}
Illegal character in array arg.
leading text: ... \begin{tabular}{|m{4cm}|m{5cm}|m{7cm}|}
Illegal character in array arg.
leading text: ... \begin{tabular}{|m{4cm}|m{5cm}|m{7cm}|}
Illegal character in array arg.
leading text: ... \begin{tabular}{|m{4cm}|m{5cm}|m{7cm}|}
Influence de la dilution
Soit :
![]()
Avec:
(11) ![]()
Pour une ka donnée, si C diminue ![]()
Un acide faible ![]() un acide fort.
un acide fort.
(12) 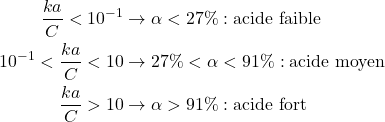
pH des sels
(13) ![]()
Par convention :
- Un acide fort une base conjuguée de force nulle
- Un acide faible une base conjuguée de force faible
- Une base forte un acide conjugué de force nulle
- Une base faible un acide conjugué de force faible
Sel d’acide fort et de base forte
Exemple:
(14) ![]()
L’acide ![]() et la base
et la base ![]() sont de force nulle.
sont de force nulle.
la solution ![]() neutre de pH = 7
neutre de pH = 7
Sel d’acide fort et de base faible
![]()
![]() acide faible de pka
acide faible de pka ![]() base de force nulle la solution a le pH de l’acide faible
base de force nulle la solution a le pH de l’acide faible ![]()
(15) 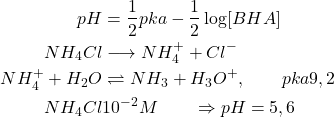
Sel d’acide faible et de base forte
(16) ![]()
![]() acide de force nulle
acide de force nulle ![]() : base de force faible
: base de force faible
la solution a le pH de la base faible ![]()
(17) ![]()
\begin{align}
CH_3COONa& \rightarrow CH_3COO^- + Na^+\\CH_3COO^- + H_2O&\rightleftharpoons CH_3COOH + OH^- \quad
pka = 4,8 \\ [CH_3COONa] &= 10^{-2}M \Rightarrow pH = 8,4
\end{align}
Sel d’acide faible et de base faible
(18) ![]()
pH du mélange de deux couples:
(19) 
On suppose que les réactions d’hydrolyse avec a et b ont la même vitesse
![]()
D’où ![]()
Donc :
(20) ![]()
pH des solutions tampons
Une solution tampon

Une solution Tampon est un mélange d’acide faible et sa base conjugué, ou inversement base faible et son acide conjugué.
Équation de HENDERSON
(21) 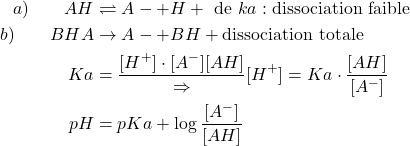
Simplifications :
(22) 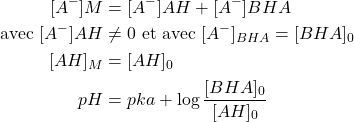
Exemple : on mélange
(23) 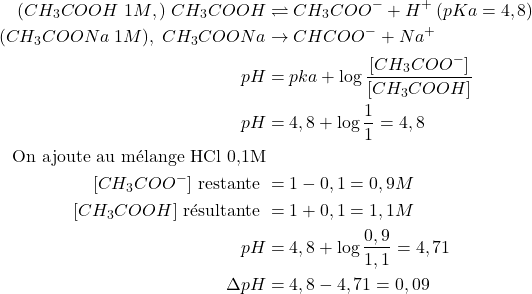
si on ajoute HCl 0,1M à l’eau distillée le pH = 1 , donc ![]() = 7 – 1 = 6
= 7 – 1 = 6
Capacité tampon et pouvoir tampon
Capacité tampon : c’est l’intervalle de pH dans le quel s’exerce l’effet tampon ![]()
Pouvoir tampon: ![]() (Q exprimée en mole).
(Q exprimée en mole).
Notion des indicateurs
Détermination colorimétrique
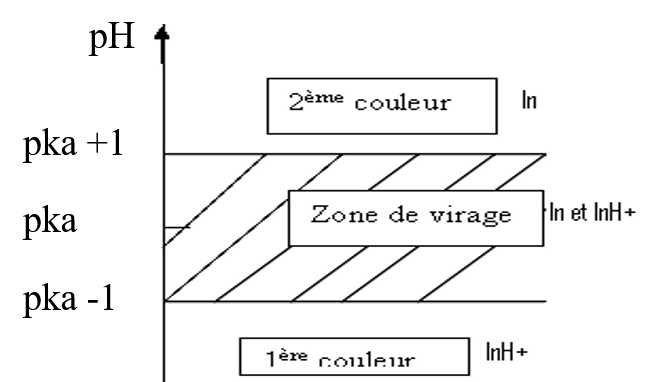
Les indicateurs de pH sont des couples acide-bases
Utilisation ↓ quantité.
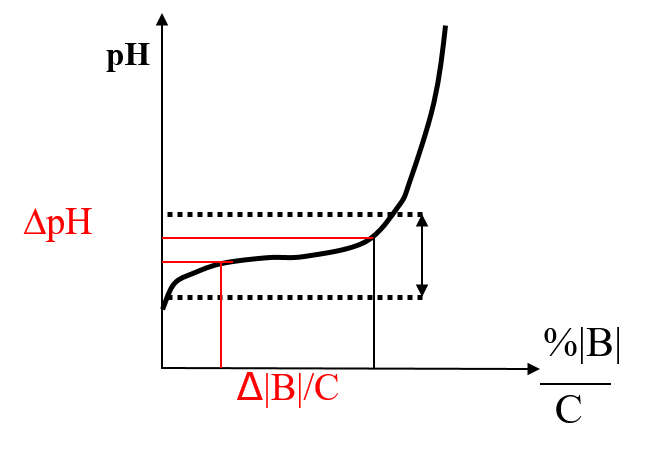
Choix de l’indicateur ; zone de virage saut de pH

Zone de virage
le pH où variera la couleur. ![]()
(24) 
Pour les indicateurs unicouleurs : ![]()
- a : la concentration à laquelle apparaît la couleur.
- C : La concentration de l’indicateur.

Choix des indicateurs colorés
Point équivalent ![]() la zone de virage
la zone de virage
Pour un acide fort / base forte ,N’importe quel indicateur. Peut ne pas contenir le point équivalent
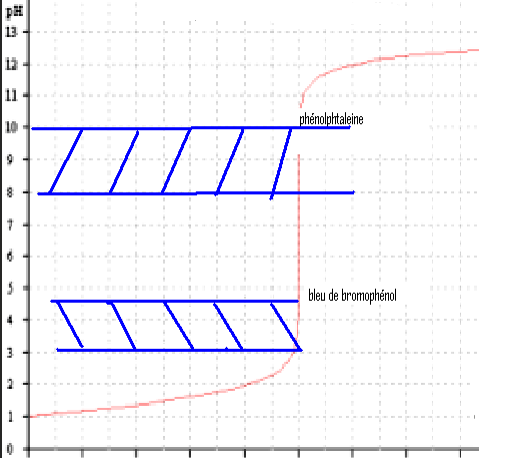
- Pour un acide faible / base forte
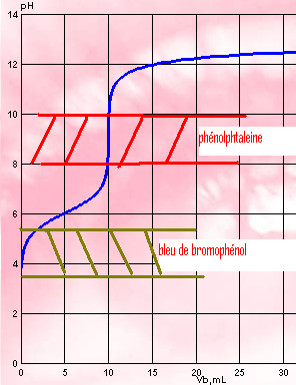
- Pour un polyacide / base forte
un indicateur composé
![]() mélange bleu de bromocrésol + phénophtaléine
mélange bleu de bromocrésol + phénophtaléine
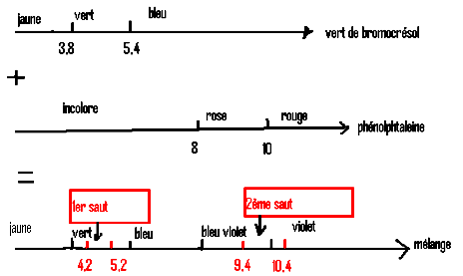
- Indicateur Tashiri
Utilisé pour le dosage de NH3 et de ses sels [C]↓
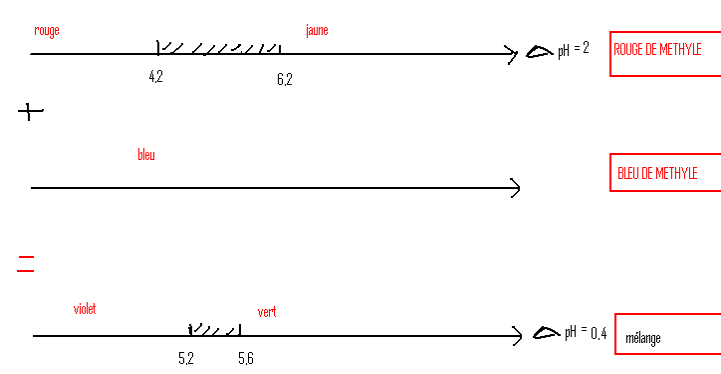
- Indicateur universel
couleur = f(pH), de Composition:
- phénophtaléine
- rouge de méthyle
- phenol-4,4′-(3h-2,1-benzoxathiol-3-ylidene)bis-2-bromomethyl-6-(1-methylethyl)-S,S-dioxyde
- phenol-4,4′-(3h-2,1-benzoxathiol-3-ylidene) bis-5-methyl-2-(1-methylethyl)-S,S-dioxyde
- solvant : eau/méthanol/propan-1-ol
Échelle de teintes

Détermination électrométrique du pH
- procédé électrométrique,
- Intérêts
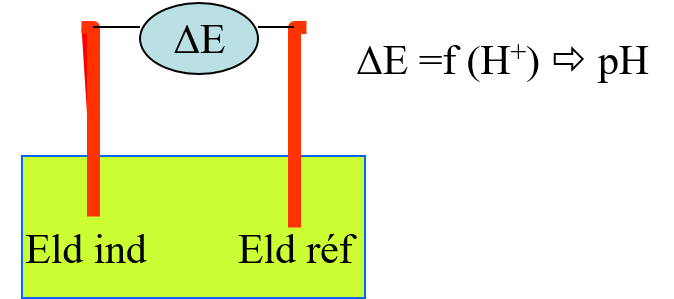
pH-mètre et électrodes

Électrode de référence : à potentiel fixe
- Calomel : Hg / Hg2Cl2 / KCl
- Sulfate mercureux : Hg / Hg2SO4 / Na2SO4
- Chlorure d’argent : Ag / AgCl / KCl
étalonner le système pHmètre-électrode
Neutralisation acide-base (courbes de dosage)
Neutralisation : acide fort / base forte
Étude de l’évolution du pH
(25) 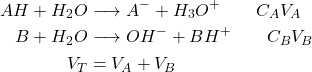
- Avant le dosage :
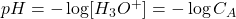
- Avant le point équivalent :
(26)

- Au point équivalent : En effet
 Solution neutre de
Solution neutre de 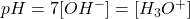
- Après le point équivalent : [B] excès; le milieu devient basique.
(27)
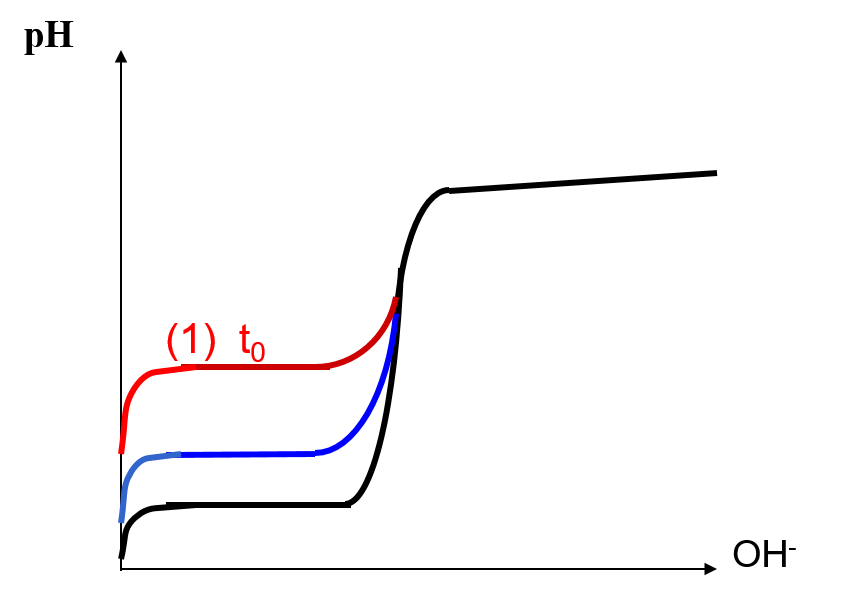
On obtient la courbe suivante :
Influence de la concentration
| X | pH(Solution 1M) | pH(Solution 0,1M) | pH(Solution 0,01M) | Précision du dosage |
| 0 | 0 | 1 | 2 | |
| 0,99& 2 &3 & 4 & | ||||
| 0,999 &3 &4 &5 &0,1\% avant | ||||
| 1& 7 & 7 & 7 & | ||||
| 1,001& 11 & 10 & 9 & 0,1\% après | ||||
| 1,01 &12 & 11 & 10& |
Neutralisation : acide faible / base forte
(28) 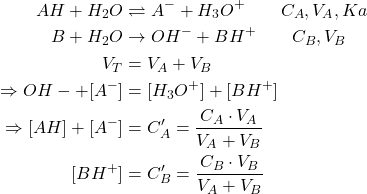
C’A et C’B sont les nouvelles concentrations dans le mélange.
- Avant le dosage :
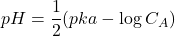
- Avant le point équivalent : solution tampon
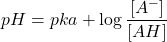 [latex]\begin{align} [A^-] &= C^\prime_B = \dfrac{C_B \cdot V_B }{V_A + V_B}\\ [AH] &= C^\prime_A – C^\prime_B = \dfrac{C_A\cdot V_A}{V_A + V_B} – \dfrac{C_B \cdot V_B}{V_A + V_B}\\ pH &= pka + \log \dfrac{C_B \cdot V_B}{ C_A\cdot V_A – C_B \cdot V_B}\end{align} [/latex]
[latex]\begin{align} [A^-] &= C^\prime_B = \dfrac{C_B \cdot V_B }{V_A + V_B}\\ [AH] &= C^\prime_A – C^\prime_B = \dfrac{C_A\cdot V_A}{V_A + V_B} – \dfrac{C_B \cdot V_B}{V_A + V_B}\\ pH &= pka + \log \dfrac{C_B \cdot V_B}{ C_A\cdot V_A – C_B \cdot V_B}\end{align} [/latex] - Au point équivalent : Tout l’acide est dissocié les ions
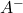 réagissent avec l’eau:
réagissent avec l’eau: 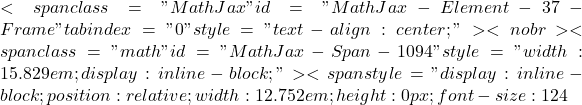 avec ka le pH
avec ka le pH 
- Après le point équivalent : On a une solution de base forte :


L’allure de la courbe obtenue :
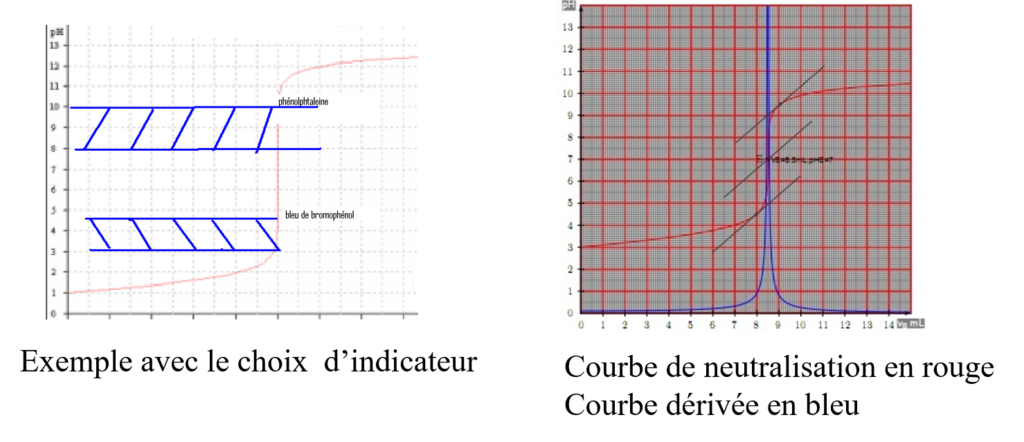
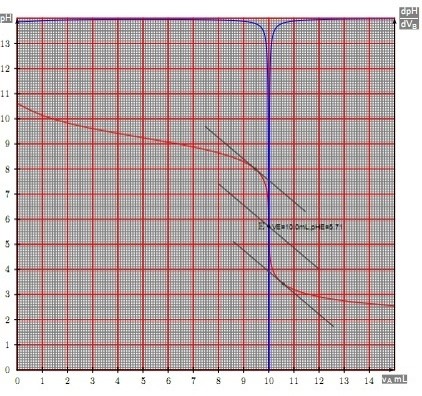
Neutralisation : base faible / acide fort
De la même façon on étudie la courbe de neutralisation d’une base faible par un acide fort

Courbe de neutralisation :
Neutralisation : polyacide / base forte
On considère l’acide ![]() de concentration CA .
de concentration CA .
(29) ![]()
- Avant le dosage : la solution de
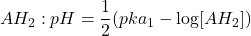
- Avant la première neutralisation : solution tampon
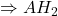 et
et 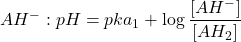
- Au premier point d’équivalence : solution de
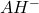 ampholyte:
ampholyte: 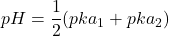
- Entre le 1er et le 2ème point équivalent : Solution tampon
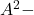 et
et 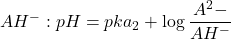
- Au 2ème point équivalent : solution de
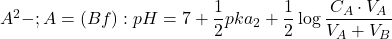
- Après le 2ème point équivalent : solution de BF
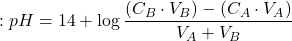
L’allure de la courbe de neutralisation :
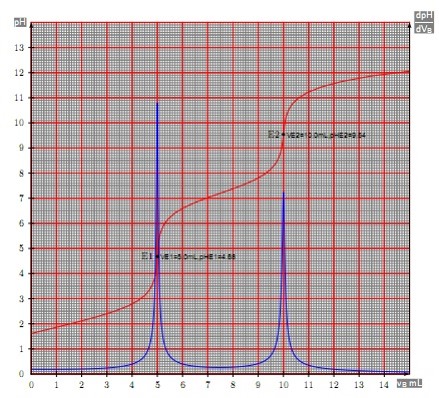
Neutralisation : polybase / acide fort
Exemple :
Na_2CO_3 (de concentration C_B) / HCl
\begin{align} CO3^{2-} + H^+ \rightarrow HCO_3^- \qquad \text{1ère basicité:} \quad pk_{a1} = 10,3\\ HCO_3^- + H^+ \rightarrow H_2CO_3 \qquad \text{2ème basicité:} \quad pk_{a2} = 6,4 \end{align}
- Avant le dosage : La solution est de CO32-,
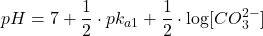
- Avant la 1ère neutralisation : solution tampon:
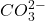 et
et 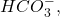

- Au 1er point d’équivalence : solution de
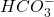 (ampholyte),
(ampholyte), 
- Entre le 1er et le 2ème point équivalent : solution tampon
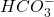 et
et 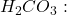

- Au 2ème point équivalent :
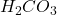 (Af),
(Af), 
- Après le 2ème point équivalent : acide fort

Quiz
[WpProQuiz 1]
Share this content:
Table des matières

