La mercurimétrie
Définition
La mercurimétrie regroupe les méthodes titrimétriques fondées sur la formation des complexes mercurimétriques, et essentiellement parmi ces complexes: les complexes chloré, bromé et cyané (Cl–, Br–, CN–)
l’équivalent analytique
Basé sur la formation du Complexe HgCl2
(1) ![]()
L’équivalent correspond à l’ion halogénure Cl– et donc au demi atome Hg2+ : E = (200,6 / 2) = 100,3
Exemple : solution titrée à 0,1N de HgO contient (HgO / 20) / litre.
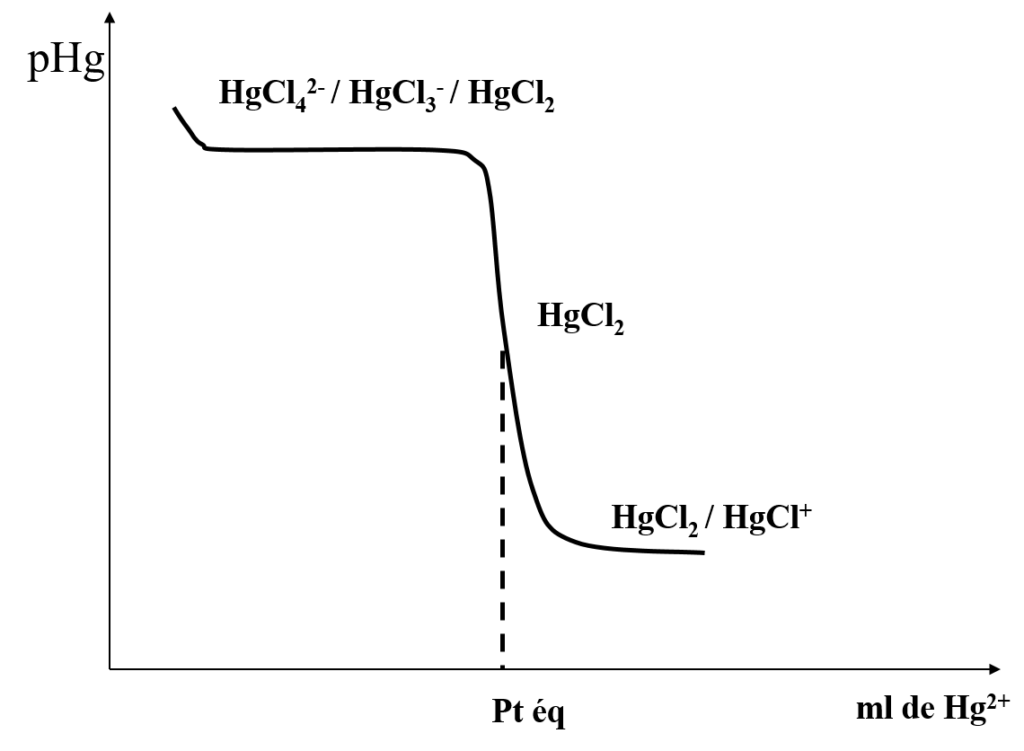
courbe de titrage
Une solution de Cl– de C0 = 0,1N le titrant Hg2+
(2) ![]()
Détermination uniquement au voisinage du point équivalent car :
a) avant le point équivalent on est en présence d’un mélange : HgCl42- ; HgCl3– ; HgCl2 puisque excès des ions Cl– .
b) après le point équivalent on est en présence du mélange HgCl2 et HgCl+.
- Dosage à 1% avant le point équivalent :
(3)
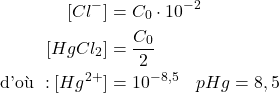
- Au point équivalent :
Solution de :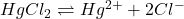
(4)
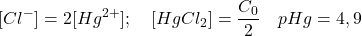
- Dosage à 1% après le point équivalent :
Excès de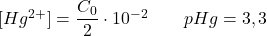
Dans cette méthode on n’utilise que des indicateur pour mettre en évidence le saut de pHg
Méthodes de dosage en mercurimétrie
Méthode de VOTOCEK
- Milieu acide nitrique
- En utilisant la formation d’un précipité blanc avec la nitroprussiate de Na : [Fe(CN)5NO]Hg précipite qui marque la fin de la réaction.
Méthode de SCHALES
- utilise comme indicateur : Diphénylcarbazone
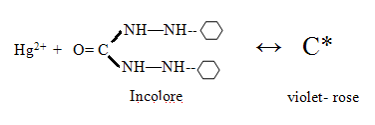
- milieu acide pH = 2 (acide nitrique)
Indicateur mixte
Bleu de bromophénol + Diphénylcarbazone
Coloration du milieu passe du : Jaune vers Violet
Application en mercurimétrie
Cl– faible : Sérum, eau …
Cl–élevée on utilise l’argentitrimétrie Ag+
Préparation des solution titrées
- A partir de HgO en milieu acide + dilution à 1 litre d’eau
- A partir de Hg(NO3)2 soluble dans l’eau, mais s’hydrolyse facilement donc il faut acidifier.
- A partir de KCl pour avoir Cl– : utilisé comme étalon.
Share this content:
Table des matières
