Manganimétrie
Applications
Titrage direct
Dosage de l’eau oxygénée H2O2 et les peroxydes:
Le peroxyde d’hydrogène H2O2 a plusieurs utilisations notamment comme agent blanchissant et comme antiseptique. Le titre des solutions est exprimé en pourcentage ou en volume de O2 libéré par volume de solution selon la réaction :
(1) ![]()
La solution indiquée comme antiseptique a un titre de 10V.
Le dosage par le permanganate est effectué en milieu acide sulfurique après dilution adéquate de la prise d’essai. Le virage est indiqué par une coloration rose persistante du KMnO4.
(2) 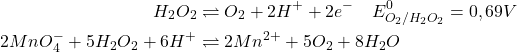
1L deMnO4– 0,1N est équivalent à 1/20 M de H2O2 et à 1/40 M d’O2
Dosage des nitrites ( NO2– ):
Si la prise d’essai contenant des nitrites est acidifiée il aura un risque de formation de l’acide nitreux HNO2 volatil.
La procédure adéquate requière de préparer une solution de l’échantillon à doser par pesée exacte et dissolution à un volume précis. Cette solution est à placer dans la burette.
Un volume précis de solution titrée de MnO4– est introduit dans un erlenmeyer et acidifié par l’acide sulfurique puis chauffé à 40°C (température adéquate pour ce dosage).
Le titrage est réalisé jusqu’à disparition de la coloration due au permanganate.
(3) ![]()
Dosage des sels ferreux (Fe2+):
Exemple : FeSO4
(4) ![]()
Pharmacopée européenne 8ème édition
Dissolvez 27,80 g de sulfate ferreux R dans 500 mL d’acide sulfurique dilué R et complétez à 1000,0 mL avec de l’eau R.
Détermination du titre.
Prélevez 25,0 mL de solution de sulfate ferreux, ajoutez 3 mL d’acide phosphorique R et titrez immédiatement par le permanganate de potassium 0,02 M. Déterminez le titre immédiatement avant l’utilisation.
- Exemple: Oxalate de
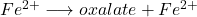 Éliminer Fe2+:(Fe(OH)_2 filtrer et doser oxalate/ MnO4– )
Éliminer Fe2+:(Fe(OH)_2 filtrer et doser oxalate/ MnO4– ) - NaBr; HBr; (Ph.Fr);
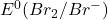 = 1,09 V 1l
= 1,09 V 1l 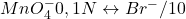
Titrage indirect
(5) 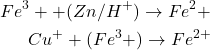
Dosage de Fe2+ par KMnO4
(6) ![]()
Filtrer, laver, test, dissoudre, doser / MnO4–
1l ![]()
Share this content:
Table des matières

