Manganimétrie
Généralités
La manganimétrie regroupe l’ensemble des méthodes titrimétriques basées sur le pouvoir oxydant de l’ion permanganate MnO4– vis-à-vis de nombreux substances réductrices. Elle se pratique essentiellement en milieu acide, mais quelques dosages sont aussi réalisés en milieu neutre ou basique.
Le permanganate est un agent oxydant très utile en analyse. La réduction en milieu acide :
(1) ![]()
- Oxydant fort en milieu acide
- Les titrages utilisant le permanganate sont réalisés de préférence en milieu acide sulfurique ( H2SO4) ou phosphorique (H3PO4).
- Éviter HCl, HNO3
- HCl : En milieu chlorhydrique Cl– sera oxyder en Cl2 par MnO4–
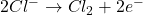
- HNO3 : À cause de la présence de HNO2 comme impureté dans HNO3
- HCl : En milieu chlorhydrique Cl– sera oxyder en Cl2 par MnO4–
Avantage :
- Auto-indicateur
- Forte coloration (0,01ml d’une solution 0,02M donne une coloration rose visible à 100 ml d’eau !)
Le permanganate peut être utilisé en solution fortement alcaline :
(2) ![]()
En solution modérément alcaline :
(3) ![]()
En réalité, même pour le système MnO4–/Mn2+ le potentiel apparent dépend du pH :
(4) ![]()
![]()
![]()
Lorsque ![]()
![]()
Le permanganate de potassium n’est pas un étalon primaire:
- Une auto-décomposition des solutions est toujours présente.
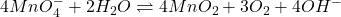
- La présence d’impuretés organiques dans l’eau est souvent cause de diminution du titre des solutions de MnO4– .
Share this content:
Table des matières

