Les méthodes d’extraction
Extraction Liquide – Solide
Introduction
Même principe que l’extraction liquide-liquide sauf que les solutés se partagent entre deux phases; une phase liquide (mobile) et une phase solide (stationnaire).
Comme pour l’extraction liquide – liquide, un équilibre s’établit:
\begin{align} [A]_l &\Leftrightarrow [A]_s\\ [A]_l &: \text{la concentration du soluté A dans la phase liquide} \\ [A]_s&: \text{concentration de A dans la phase stationnaire} \end{align}
On définit alors un coefficient de distribution :
\begin{align}K = \dfrac{[A]_s}{[A]_l}\end{align}
Le choix de la phase stationnaire et de la phase mobile est fait selon les groupements fonctionnels des solutés à extraire.
Les interactions peuvent suivre des mécanismes:
- d’adsorption,
- d’échange d’ions
- de partage
Les interactions se font entre:
- Soluté/phase mobile
- Soluté/phase stationnaire
- Phase mobile/phase stationnaire
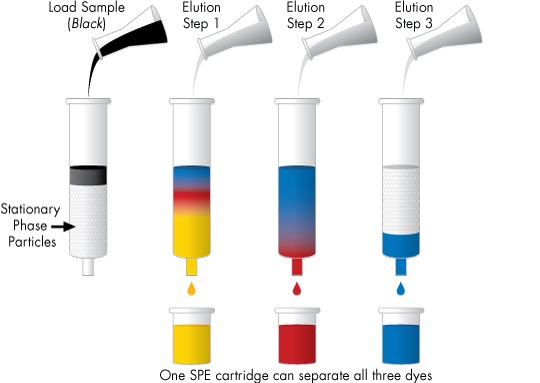
L’extraction Liquide – Solide est constituée de quatre étapes.
- 1ère étape : le conditionnement de la phase solide est obligatoire, dans le but de la rincer, l’activer, et enfin de la saturer le même solvant que celui qui contient l’échantillon.
- 2ème étape : la rétention. Le passage de la solution échantillon permet la fixation des solutés sur la phase solide, dont le composé d’intérêt .
- 3ème étape : le rinçage. Cette étape correspond à l’élution sélective des solutés à éliminer, par l’utilisation de volumes successifs de solvants de polarités croissantes ou décroissantes. Ces solvants de rinçages sont choisis comme non éluants pour le composé d’intérêt .
- 4ème étape : l’élution. Suite au rinçage, est employé le solvant adéquat permettant le » décrochage » du soluté. Un volume minimal de ce solvant peut être employé, permettant ainsi d’obtenir l’éluat du soluté à concentration plus élevée que celle de l’échantillon.
Séparation par adsorption
Ce phénomène fait intervenir des forces interactions électrostatiques, liaisons hydrogène, transfert de charge,…) cette fixation est réversible.
L’extraction se fait par élution à l’aide d’un solvant ce qui entraîne la rupture de liaison adsorbant – soluté et la remplace par liaison adsorbant – éluant (phase mobile) .
- La phase stationnaire peut être:
- Gel de silice SiO2
- Alumine Al2O3, nH2O
- Polymères organiques
- Charbon actif
- Eluant (phase mobile)
- La création d’interactions éluant /solutés impliquent que ces derniers soient solubles dans l’éluant.
- L’ensemble de ces interactions définit la force d’élution d’un solvant. Cette force est assimilée à l’énergie d’adsorption des molécules de solvant sur l’adsorbant.
Séparation par partage
la séparation est fondée sur un partage des solutés entre la phase stationnaire et la phase mobile. Celle-ci peut être polaire ou apolaire. Les deux phases sont liquides:
- Phase mobile: solvant d’élution
- Phase stationnaire : un liquide greffé sur un support solide (ex: silice greffée par un liquide polaire ou apolaire)
Séparation par échangeurs d’ions
Des interactions de type électrostatiques ont lieu entre un soluté chargé (+ ou -) et une phase solide portant des charges opposées .
Deux cas d’échanges peuvent se présenter:
- Cationique (soluté + / phase stationnaire – )
- Anionique (soluté – / phase stationnaire +).
Interactions fortement dépendantes du pH.
Phases stationnaires utilisées sont des polymères organiques (polystyrène, cellulose, polyméthane) sur lesquels sont greffés des groupements chimiques électriquement chargés.
Share this content: