Les méthodes d’extraction
Définitions
D’origine naturelle ou synthèse chimique, les substances trouvées requièrent l’usage de méthodes d’analyse polyvalentes, il s’agit à la fois de détecter et d’identifier des composés extrêmement diversifiés. Ainsi l’application de procédures rigoureuses opérant par étapes. Préparer rigoureusement les échantillons (étape fondamentale du processus analytique), le prétraitement des échantillons consiste soit à préconcentrer des substances en teneur trop faible pour pouvoir être détectées directement, soit à les séparer d’une matrice excessivement complexe.
cette étape préliminaire consomme près de 60 % du temps requis pour réaliser une analyse globale. Aujourd’hui, les chercheurs ont développé une palette de techniques rapides, économiques, automatisées et fiables pour traiter leurs échantillons selon leur nature ou le niveau de concentration recherché.
Une extraction correspond au transfert d’un soluté du milieu dans lequel il se trouve, vers un second milieu en vue de son isolement.
Le principe est fondé sur la distribution du soluté entre deux milieux non miscibles.
On distingue:
- Extraction liquide – liquide : le soluté dissout dans un liquide passe dans un autre liquide non miscible au premier.
- Extraction liquide – solide : passage du soluté d’un milieu liquide à un milieu solide de structure et propriétés bien définies.
- Extraction solide – liquide : l’échantillon est un solide; le soluté passe du milieu solide à un milieu liquide qui est le solvant d’extraction.
Techniques extractives
Le procédé d’extraction est basé sur la différence de solubilités des composés d’un mélange dans un solvant.
Le mélange peut être solide ou liquide et le solvant liquide ou fluide supercritique ou subcritique. Il existe plusieurs techniques d’extraction des produits de haute valeur ajoutée présents dans les plantes par exemple.
Ces techniques peuvent être dites conventionnelles (utilisées depuis longtemps) et nouvelles (développées plus récemment) .
- Techniques conventionnelles: Parmi ces techniques on trouve l’entrainement à la vapeur (hydrodistillation) l’extraction par Soxhlet , l’extraction en mode batch et l’extraction assistée par sonication.
- Techniques nouvelles: Dans cette catégorie on peut citer l’extraction assistée par microondes et l’extraction avec des fluides supercritiques ou subcritiques. Il existe également d’autre techniques extractives, comme, par exemple, l’extraction Solide – Liquide à moyenne pression dont le principe est le suivant : le solvant, alimenté par une pompe, traverse sous une certaine pression (
 10 bar ) une colonne remplie de matériel à extraire (colonne à lit fixe).
10 bar ) une colonne remplie de matériel à extraire (colonne à lit fixe).
Rappels
Polarité
C’est la caractéristique d’une molécule dont les charges négatives et positives sont concentrées les unes à l’opposé des autres, aux deux bouts de la molécule.
(1) ![]()
Une molécule polaire est caractérisée par son moment dipolaire ![]() (Unité: debye « C.m »):
(Unité: debye « C.m »):
(2) 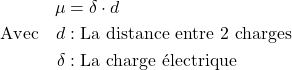
- Les molécules polaires: possèdent un ou plusieurs hétéro-atomes (N, O, S, Cl,…).
- Les molécules azotées et oxygénées sont plus polaires que les molécules halogénées.
- les molécules apolaires:
- Le moment dipolaire est nul
- Le barycentre des charges partielles positives coïncide avec le barycentre des charges partielles négatives.
- Ce sont des chaînes hydrocarbonées ( pentane, hexane… )
Constante diélectrique 
S’obtient en multipliant la constante diélectrique relative au vide (ou à l’air) du matériau par la constante diélectrique absolue du vide (ou de l’air), exprimée en picofarad par mètre.
(3) ![]()
Solubilité
Une molécule sera soluble dans un solvant de polarité proche:
- un solvant polaire solubilise les solutés polaires
- un solvant apolaire solubilise les solutés apolaires
Les relations entre soluté et solvant reposent sur:
- la formation de liaisons hydrogène
- les interactions électrostatiques
- les interactions de type Van der Waals
Classification des solvants
Pour classer les solvants on utilise trois propriétés:
- le caractère polaire: qui repose sur la valeur du moment dipolaire \mu
- le caractère dissociant: qui dépend de la constante diélectrique du solvant

- l’aptitude à créer des liaisons hydrogène: caractère protonique, mesuré par le pKa du solvant
Selon leurs interactions avec les solutés
Un solvant est polaire s’il a un moment dipolaire et une constante diélectrique.
Un solvant est protique s’il peut former des liaisons hydrogène
Solvants protiques polaires
Formation de liaisons hydrogène, fort pouvoir ionisant et pouvoir séparateur élevé. Ils sont souvent solubles dans l’eau : H2O, alcools, acides carboxyliques.
| Solvant | Formule chimique | Temperature d’ébulution | Constante diélectrique | Masse volumique | Moment dipolaire |
| Acide formique | H-C(=O)OH | 101°C | 58 | 1,21 g.ml-1 | 1,41 D |
| Butan-1-ol | CH3-CH2-CH2-CH2-OH | 118°C | 18 | 0,810 g.ml-1 | 1,63 D |
| Iso-propanol | CH3-CH(OH)-CH3 | 82°C | 18 | 0,785 g.ml-1 | 1,66 D |
| Propan-1-ol | CH3-CH2-CH2-OH | 97°C | 20 | 0,803 g.ml-1 | 1,68 D |
| Ethanol | CH3-CH2-OH | 79°C | 24 | 0,789 g.ml-1 | 1,69 D |
| Méthanol | CH3-OH | 65°C | 33 | 0,791 g.ml-1 | 1,70 D |
| Acide acétique | CH3-C(=O)OH | 118°C | 6,2 | 1,049 g.ml-1 | 1,74 D |
| Eau | H-O-H | 100°C | 80 | 1,000 g.ml-1 | 1,85 D |
Solvants aprotiques dipolaires
Ne forment pas de liaison hydrogène, leurs molécules agissent comme des dipôles. On observe que des charges opposées: Les alcoolates solvatent les cations, mais pas les anions.
Ils possèdent un fort moment dipolaire et une constante diélectrique élevée.
On retrouve : Dimethylformamide (DMF), Dimethylsulfoxide (DMSO), acetonitrile (CH3CN).
Solvants aprotiques peu polaires
Ces solvants possèdent un moment dipolaire faible. Ils ne peuvent pas former de liaison hydrogène. Ex: éthers, thioéthers, Tetrahydrofurane (THF)
| Solvant | Formule chimique | Temperature d’ébulution | Constante diélectrique | Masse volumique | Moment dipolaire |
| Dichlorométhane (DCM) | CH2Cl2 | 40°C | 9,1 | 1,326 g.ml-1 | 1,60 D |
| Tetrahydrofurane (THF) | /-CH2-CH2-O-CH2-CH2-/ | 66°C | 7,5 | 0,886 g.ml-1 | 1,75 D |
| Acétate d’éthyle | CH3-C(=O)-O-CH2-CH3 | 77°C | 6,0 | 0,894 g.ml-1 | 1,78 D |
| Acétone | CH3-C(=O)-CH3 | 56°C | 21 | 0,786 g.ml-1 | 2,88 D |
| Diméthylformamide (DMF) | H-C(=O)-N(CH3)2 | 153°C | 38 | 0,944 g.ml-1 | 3,82 D |
| Acétonitrile (MeCN) | CH3-CN | 82°C | 37 | 0,786 g.ml-1 | 3,92 D |
| Diméthylsulfoxide (DMSO) | CH3-S(=O)-CH3 | 189°C | 47 | 1,092 g.ml-1 | 3,96D |
| Carbonate de propylène | C4H6O3 | 240°C | 64,0 | 1,205 g.ml-1 | 4,9 D |
Solvants aprotiques apolaires
Ces solvants sont souvent insolubles dans l’eau. hexane, benzène, toluène, CCl4
| Solvant | Formule chimique | Température d’ébullition | Constante diélectrique | Masse volumique | Moment dipolaire |
|---|---|---|---|---|---|
| Pentane | CH3-CH2-CH2-CH2-CH3 | 36 °C | 1,84 | 0,626 g.ml-1 | 0.00 D |
| Cyclopentane | C5H10 | 40 °C | 1,97 | 0,751 g.ml-1 | 0,00 D |
| Hexane | CH3-CH2-CH2-CH2-CH2-CH3 | 69 °C | 1,88 | 0,655 g.ml-1 | 0,00 D |
| Cyclohexane | C6H12 | 80,75 °C | 2,02 | 0,7786 g.ml-1 | 0,00 D |
| Benzène | C6H6 | 80 °C | 2,3 | 0,879 g.ml-1 | 0,00 D |
| Toluène | C6H5-CH3 | 111 °C | 2,4 | 0,867 g.ml-1 | 0,36 D |
| 1.4-dioxane | /-CH2-CH2-O-CH2-CH2-O-\ | 101 °C | 2,3 | 1,033 g.ml-1 | 0,45 D |
| Chloroforme | CHCI3 | 61 °C | 4,8 | 1,48 g.ml-1 | 1,04 D |
| Éther diéthylique | CH3CH2-O-CH9-CH3 | 35 °C | 4,3 | 0,713 g.ml-1 | 1,15 D |
Selon le pouvoir dissociant
| Solvants dissociants | Eau, DMSO, Glycérol, Acide sulfurique… | |
| Solvants intermédiaires | Ethanol, Ethylène glycol, Acétone, Acétonitrile… | |
| Solvants très peu dissociants | Pyridine, Dichloro-1,2-éthane,Éther, Cyclohexane … |
Selon la famille de solvants
Miscibilité des solvants
Dépend des structures chimiques et de la polarité des solvants.
En biologie, l’extraction se fait essentiellement à partir d’une phase aqueuse (plasma, urine, LCR…)
le choix du solvant d’extraction dépend de la solubilité du composé à extraire dans ce solvant. Et de non de miscibilité dans l’eau.

Share this content: