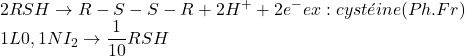Iodométrie-iodimétrie
Applications
I2 = oxydant (iodométrie)
Dosage de Povidone iodée
Tout les composés qui ont un potentiel standard suffisamment inférieur à 0,54 V peuvent être dosés par l’iode.
Soufre et dérivés soufrés
Sels métalliques (valence inférieur)
(1) ![]()
La réaction de titrage par I2 est la suivante:
(2) ![]()
Remarque: Risque d’oxydation de Sn2+ par l’oxygène.
(3) ![]()
Les sels mercureux (Exemple: Calomel Hg2Cl2) peuvent être titrés par une solution de I2 en présence de I– selon la réaction:
\begin{align} Hg_2Cl_2 + I_2 + 6 I^- \rightarrow {2}HgI_4^{2-} + 2 Cl^- \end{align}
Il se forme le complexe tetraiodomercurate II [HgI4]2-. C’est un titrage en retour, l’excès d’iode est titré par thiosulfate.
Double liaisons
Dosage de la vitamine C
Acide ascorbique (E° = 0,02V) (Pharmacopée Française)
(4) ![]()
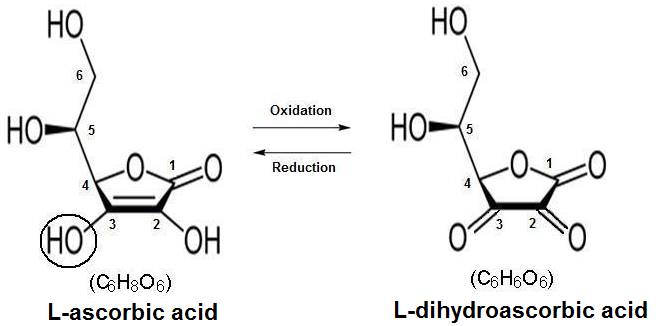
Le titrage est réalisé en milieu acide par une solution de I2 en présence de l’empois d’amidon.
Indice d’iode
L’iode ( I2 ) s’additionne mal sur les doubles liaisons (réaction lente). On utilise pour les dosages des composés iodés tels que le Chlorure d’Iode ICl : méthode de WIJS.
Principe de la méthode de Wijs
On fait agir le chlorure d’iode dans l’acide acétique, sur le corps gras dissout dans le tétrachlorure de carbone CCl4 ou le chloroforme CHCl3 : Il y a addition de ICl sur les doubles liaisons :
(5) ![]()
Le chlorure d’iode étant en excès, On libère l’Iode qu’il renferme par action de l’iodure de potassium :
(6) ![]()
On utilise un excès d’iodure pour dissoudre l’iode libéré.
L’iode ainsi libéré est dosé par une solution de S2O32- de titre connu. On procède parallèlement à un essai témoin qui permettra de connaître exactement la quantité d’iode introduite sous forme de ICl.
Arsenic et dérivés
-
 (voir étalonnage)
(voir étalonnage) - Drivés organiques d’Arsenic.
Pénicillines
Remarques
- Réaction lente (Dosage en retour)
- Risque d’oxydation (éviter O2… )
- Influence de pH/E
- Indicateur est l’empois d’amidon
I– = Réducteur (Iodimétrie)
Aions oxydants: ![]()
\begin{align} AsO_4^{3-} + 2H^{+} \nearrow {+} 2I^{-} \text{(en excés)} \rightarrow AsO_3^{3-} + I_2 + H_2O (\text{ En retour}) \end{align}
AsO43- : Arséniates. AsO33- : Arsénites.
Pas de dosage direct car S2O32- s’oxyde en SO42-
NB:
- une petite partie de
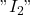 provient de l’oxydation de
provient de l’oxydation de 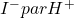
- Éliminer
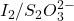 (en présence de
(en présence de 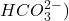 , stop au point équivalent puis doser
, stop au point équivalent puis doser 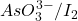 étalon
étalon
begin{figure}[h!]
{renewcommand{arraystretch}{1}
renewcommand{tabcolsep}{0.2cm}
centering
begin{tabular}{c@{}l}
begin{tabular}{ll@{}}
%textbf{Schéma générale du dosage en bromométrie} &
begin{tikzpicture}[scale=2]
draw|-| — (1,0) ;
end{tikzpicture}
&ce{AsO_4^3-}
begin{tikzpicture}[scale=2]
draw|-> — (2,0) ;
end{tikzpicture}
&ce{I^-}
begin{tikzpicture}[scale=2]
draw|-> — (2.5,0) ;
end{tikzpicture}
&ce{HCl}
begin{tikzpicture}[scale=2]
draw|-| — (1,0) ;
end{tikzpicture}
&ce{I_2}
begin{tikzpicture}[scale=2]
draw|-| — (1,0) ;
end{tikzpicture}
&ce{S_2O_3}
begin{tikzpicture}[scale=2]
draw|-| — (1,0) ;
end{tikzpicture}
&ce{AsO_3^3-}
begin{tikzpicture}[scale=2]
draw|-| — (1,0) ;
end{tikzpicture}
&ce{I_2}
end{tabular}
&
[/latex]begin{array}{l}
MyLBrace{4ex}{Bain marie bouillant}
MyLBrace{6ex}{Milieu bicarbonaté}
%MyLBrace{4.4ex}{things beginning and ending with t}
end{array}[/latex]
end{tabular}
caption{Schéma générale du dosage des ions oxydants}
end{figure}
Composés peroxygénés:
Eau oxygénée
(7) 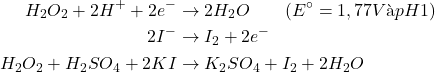
Titre de ![]()
Autres peroxydes et les persels
MgO2; ZnO2
Persels
![]()
Ces composés réagissent en milieu acide sur les iodures comme pour H2O2
Composés halogénés: hypochlorite
L’hypochlorite de sodium en solution est appelé eau de Javel. Elle est préparée notamment par action du chlore gazeux ( ![]() ) sur une solution de soude
) sur une solution de soude ![]() à froid selon la réaction:
à froid selon la réaction:
Réaction de formation :
(8) 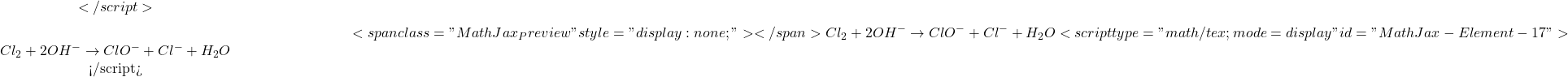
Le soluté de Dakin est une solution antiseptique d’hypochlorite diluée d’eau de Javel (à 1,5°) renfermant de l’hydrogénocarbonate de sodium pour atténuer l’alcalinité de l’eau de Javel irritante pour les tissus. .
Pour le degré chlorométrique il s’agit d’une « rétro dismutation » de la réaction de dissolution du dichlore gazeux dans l’eau (Pharmacopée Française):
Principe :
Oxydation de l’iodure de potassium en milieu acétique et titrage de l’iode libéré par une solution décinormale de thiosulfate de sodium.
(9) 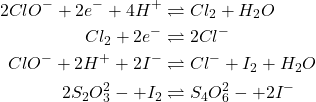
1 litre de thiosulfate 0,10 N est susceptible de réduire, par l’intermédiaire d’iodure, 1/20 de mole de ClO– . 1/20 mole de ClO– donne naissance , à 1/20 de molécule-gramme de dichlore soit 1,12 litre ou 3,545 g de « chlore actif ».
voir pharmacopée européenne.
HClO pKa= 7,3
(10) ![]()
Milieu acétique; pas de HX car:
Lorsque la solution est trop fortement acidifiée, la petite quantité de chlorates ( ClO3– ) que contient l’hypochlorite selon la réaction de dismutation suivante:
(11) 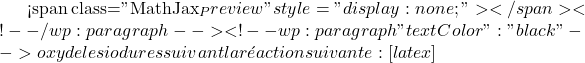
Réaction de décomposition:
1 litre ![]()
NB: ClO– se décompose d’où on utilise des conservateurs.
Titre: (Réaction de décomposition)
Le degré chlorométrique (français): est le nombre de litres de (di)chlore susceptible d’être dégagé par un litre de solution ou 1 Kg de produit sous l’action d’un acide à une température de 0 degré centigrade et à une pression de 1013,25 millibars (PTN) .
Degré chlorométrique Anglais: Nombre de grammes de Cl2 libéré par 100g de produit.
Sels métalliques de valence supérieures:
Certains sels métalliques de valence supérieure peuvent etre titrés par iodimétrie.
Action de ![]() en excès en milieu acide avec libération de I2 qui sera dosé par le
en excès en milieu acide avec libération de I2 qui sera dosé par le ![]()
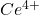
(12)
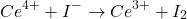
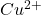
(13)
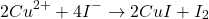
(14)
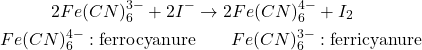
Applications au dosage de la glycémie:
%begin{table}[h!]
%begin{tabular}{ll}
% begin{tikzpicture}[scale=2]
% draw|-| — (1,0) ;
% end{tikzpicture}
% & ce{Sucre réducteur}
% begin{tikzpicture}[scale=2]
% draw|-| — (2,0) ;
% end{tikzpicture}
% &ce{Fe(CN)_6^{3-}} excès/OH- ajoutée
% begin{tikzpicture}[scale=2]
% draw|-|(1,0) — (2,0) ;
% end{tikzpicture}
% &ce{I^- /H^+}
% begin{tikzpicture}[scale=2]
% draw|-|(1,0) — (2,0) ;
% end{tikzpicture}
% &ce{I_2 /S_2O_3^2-}
% end{tabular}
% caption{Schéma du dosage de l’étalonnage de ce{I_2} par l’hydrazine}
% end{table}
begin{figure}[h!]
{renewcommand{arraystretch}{1}
renewcommand{tabcolsep}{0.2cm}
centering
begin{tabular}{ll}
%textbf{Schéma générale du dosage en bromométrie} &
begin{tikzpicture}[scale=2]
draw|-| — (1,0) ;
end{tikzpicture}
&Sucre réducteur
begin{tikzpicture}[scale=2]
draw|-| — (2,0) ;
end{tikzpicture}
&ce{Fe(CN)_6^{3-}} excès/ce{OH^-}
begin{tikzpicture}[scale=2]
draw|->(1,0)– (2.5,0) ;
end{tikzpicture}
&ce{H^+, I^-} en excès
begin{tikzpicture}[scale=2]
draw|-|(1,0) — (2,0) ;
end{tikzpicture}
&ce{I_2} formée
begin{tikzpicture}[scale=2]
draw|-|(1,0) — (2,0) ;
end{tikzpicture}
&ce{S_2O_3} versé(mL)
end{tabular}
caption{Schéma générale de l’étalonnage de ce{S_2O_3} par IO_3^-}
end{figure}
Sucre(x) + ![]() (précipité rouge)
(précipité rouge)
- lavé; oxydé par
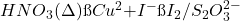
- ou lavé; oxydé par
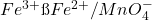
![]()
Application indirecte: dosage de ![]()
(15) ![]()
Passage en milieu ![]() : l’excès de
: l’excès de ![]() précipite.
précipite.
Reste: ![]() libre à doser équivalent à la quantité de
libre à doser équivalent à la quantité de ![]() initiale.
initiale.
[latex]
Share this content:
Table des matières