Iodométrie-iodimétrie
Étalonnage
Étalonnage des solutions de I2
Avec le thiosulfate S2O32-
- Utiliser une solution de Na2S2O3 récemment étalonnée, de préférence avec KIO3 pur.
- Transférer 25 mL de la solution de I2 dans un erlenmeyer, diluer à 100 mL
- Ajouter à la burette la solution étalon de thiosulfate jusqu’à obtenir une couleur jaune pale.
- Ajouter 2 mL de la solution d’amidon et poursuivre lentement l’addition du thiosulfate jusqu’au virage (solution incolore).
(1) ![]()
Avec l’anhydride arsénieux As2O3
L’anhydride arsénieux se dissout instantanément en milieu basique pour donner des ions arsénites : H2AsO3–.
(2) 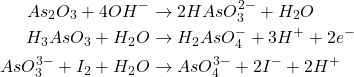
Généralement on utilise une solution 0,1N.
1 litre d’une solution ![]()
L’équivalent pour l’anhydride arsénieux correspond au quart de la molécule gramme.
soit : ![]()
L’étalonnage se fait en versant la solution d’iode à la burette sur la solution arsénieuse convenablement tamponnée à l’aide d’un excès de carbonate acide de Na ou de K , car l’oxydation s’accompagne d’une libération de H+ .
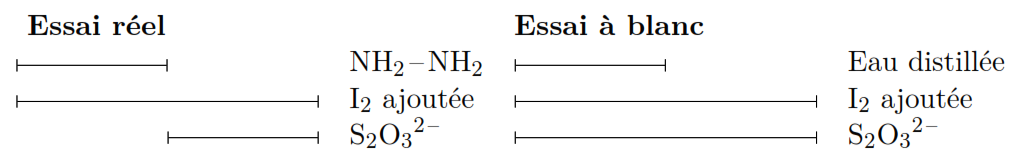
Avec sulfate d’hydrazine NH2-NH2, (H2SO4)
La réaction d’oxydo-réduction est lente d’ou le recours au dosage en retour
(3) ![]()
L’équivalent correspond au quart de la molécule gramme soit ![]() 32,53 g
32,53 g
1 litre d’une solution NH2-NH2 0,1N![]() (1/40)mole/l
(1/40)mole/l
Même chose que l’anhydride arsénieux, il faut ajouter un excès de carbonate acide de Na ou de K au cours du dosage.
NB: penser à réaliser un essai à blanc (sans NH2-NH2) pas besoin de connaitre le titre de S2O32- on le calcule
Etalonnage des solutions de S2O32-
Avec des étalons primaires
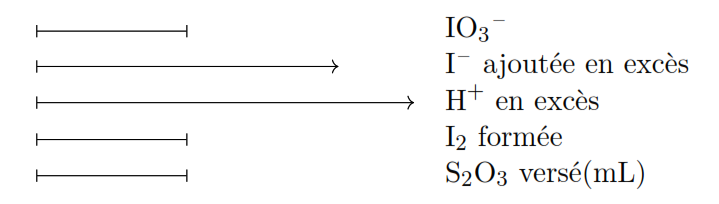
Iodate de potassium KIO3. PM(KIO3) = 214,02
(4) ![]()
L’équivalent de KIO3 (PM = 214,02) correspond au sixième de la molécule gramme ( ![]() ).
).
Soit ![]() 35,67 g, donc une solution 0,1 N contient 3,567 g d’iodate de potassium par litre.
35,67 g, donc une solution 0,1 N contient 3,567 g d’iodate de potassium par litre.
Bromate de potassium KBrO3. PM(KBrO3) = 167,01
(5) ![]()
L’équivalent de KBrO3 (PM = 167,01) correspond au sixième de la molécule gramme ( ![]() ).
).
Soit ![]() , donc une solution 0,1 N contient 2,784 g de Bromate de potassium par litre
, donc une solution 0,1 N contient 2,784 g de Bromate de potassium par litre
Bichromate de potassium K2Cr2O7. PM(K2Cr2O7) = 294,21
(6) 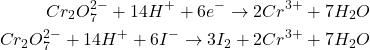
L’équivalent de K2Cr2O7 (PM = 294,21) correspond au sixième de la molécule gramme.
Soit ![]() , donc une solution 0,1 N contient 4,904 g de Bromate de potassium par litre.
, donc une solution 0,1 N contient 4,904 g de Bromate de potassium par litre.
Une solution de K2Cr2O7 0,1N est équivalente à ![]() .
.
Les ions Cr3+ possèdent une coloration bleu-verdâtre , le virage à lieu du bleu au vert pâle.
Indicateur est l’empois d’amidon.
Avec des étalons secondaires
- I2, MnO4–
(7)
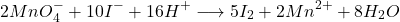
- Ce4+, H+ (voir KIO3, I–)
(8)
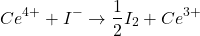
Share this content:
Table des matières

