Iodométrie-iodimétrie
Préparation des solutions titrées
Solution titrée d’iode ( I2)
L’iode étant très peu soluble dans l’eau, il est nécessaire d’ajouter un excès de KI pour former l’ion complexe periodure I3–.
L’équivalent correspond à l’atome-gramme d’iode. On prépare généralement une solution 0,1 N
![]()
- Pur, mais tension de vapeur élevée (non étalon primaire)
- Éviter
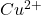 et
et 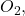 l’eau doit etre exempte de cuivre, car il facilite l’oxydation de
l’eau doit etre exempte de cuivre, car il facilite l’oxydation de 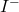 par
par 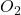 de l’air avec liberation de
de l’air avec liberation de 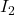 .
. (1)
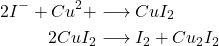
- Conservation: (absence d’Ox; flacon de verre)
- Évaporation: le titre diminue
Exemple: Solution d’iode 0,05 M (0,1N):
Dissoudre un léger excès 12,75 g d’iode (balance ordinaire) et 25 g d’iodure de potassium dans de l’eau distillée et compléter à 1000,0 mL avec le même solvant. Garder dans des flacons à bouchon de verre, de préférence au froid et à l’abri de la lumière.
Solution antagoniste titrée de thiosulfate ( S2O32- )
L’équivalent correspond à la molécule-gramme. E = PM = 248,2 g . On prépare généralement une solution de titre voisin de 0,1 N.
- Réducteur (non étalon primaire)
- Hygroscopique
- Pas de stabilité (air), l’eau doit être exempte de
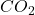 par ébullition.
par ébullition. - La solution est relativement instable,
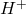 et
et 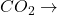 décomposition (
décomposition (  )
)
\begin{align}
HS_2O_3^- + H^+ \rightleftharpoons SO_2 + H_2O + S
\end{align}
- Sensibilité aux moisissures d’où l’intérêt d’ajouter des conservateurs: alcool amylique, borate de Na, chloroforme, HgI2 ….
(2) ![]()
Il est recommandé de vérifier son titre avant chaque utilisation.
Share this content:
Table des matières

