Iodométrie-iodimétrie
Aspects généraux
Principe
- L’iodométrie est la technique de dosage qui fait appel au pouvoir oxydant de l’iode pour doser les réducteurs.
- L’iodimétrie est la technique de dosage qui fait appel au pouvoir réducteur des iodures pour doser les oxydant
(1) ![]()
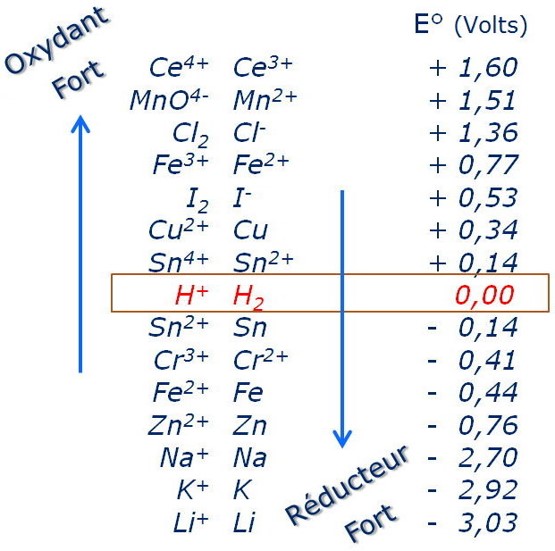
L’iode ![]() est un oxydant moyennement fort.
est un oxydant moyennement fort.
(2) ![]()
La solution d’iode (S = 0,335 g/l) est plus facilement préparée en excès d’ions iodure ![]() (meilleure solubilité)
(meilleure solubilité)
(3) ![]()
Par simplification les réactions impliquant ![]() sont écrites en utilisant simplement I2.
sont écrites en utilisant simplement I2.
- Des substances fortement réductrices peuvent être quantitativement oxydées par l’iode même en solutions acides
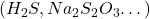 (Iodométrie).
(Iodométrie). - Pour d’autres, à pouvoir réducteur moins fort la réaction complète avec I2 ne peut se faire qu’en milieu neutre
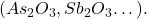
- Des substances oxydantes peuvent réagir complètement avec un excès d’iodures
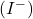 donnant une quantité équivalente de I2 qui est déterminée par une solution titrée réductrice de
donnant une quantité équivalente de I2 qui est déterminée par une solution titrée réductrice de 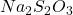 (Iodimétrie).
(Iodimétrie).
Influence du pH
Le potentiel normal du couple I2 /I– est indépendant du pH tant que celui-ci est inferieur à 8.
À pH très basique, l’iode réagit avec les ions hydroxyde pour former des iodures et l’espèce instable hypoiodite qui donne des iodates et des iodures.
Deux difficultés supplémentaires peuvent être cause d’erreurs dans les titrages à l’iode :
- La volatilité appréciable de I2 peut induire des pertes (diminution du titre de la solution)
- L’oxydation des iodures en solutions acide par l’oxygène de l’air :
(4)
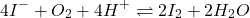
Une alternative pouvant contourner ces difficultés est d’utiliser une solution d’iodures et de iodates de potassium. Cette solution est parfaitement stable et donne de l’iode en milieu acide selon la réaction :
(5) ![]()
L’iodate de potassium (KIO3) étant un sel pur (étalon primaire), on peut en dissoudre une quantité pesée avec précision en présence d’un léger excès d’iodures de potassium (KI) en présence d’acide fort pour avoir un volume déterminé d’une solution étalon de diode de titre exact
Détection du point de fin de titrage en iodométrie
L’iode peut être son propre indicateur. La solution d’iode possède une coloration qui va du jaune vif au brun selon la concentration.
Cette coloration reste perceptible à une faible concentration si les autres constituants du milieu réactionnel sont parfaitement incolores.
%(une goutte d’iode à 0,05 M donne une coloration jaune pale visible à 100 ml d’eau).
La détection de la présence d’I2 est beaucoup améliorée par l’usage d’une solution d’empois d’amidon qui donne une coloration bleu vive.
% avec I2 à de très faibles concentrations (de l’ordre de ![]() .
.

Étape de dosage de l'iode par thiosulfate L’amidon est peu couteux mais présente l’inconvénient d’être peu soluble dans l’eau froide et le risque de former des complexes composés insolubles avec l’iode.
![]()
Le glycolate sodique d’amidon est un indicateur qui permet de remédier aux inconvénients de l’empois d’amidon. Sa solution est stable et ne donne pas de composés insolubles, la coloration est verte en présence d’une forte concentration de I2 . Elle devient bleue vive avant l’équivalence et vire à l’incolore d’une façon très nette au point d’équivalence.
Share this content:
Table des matières

