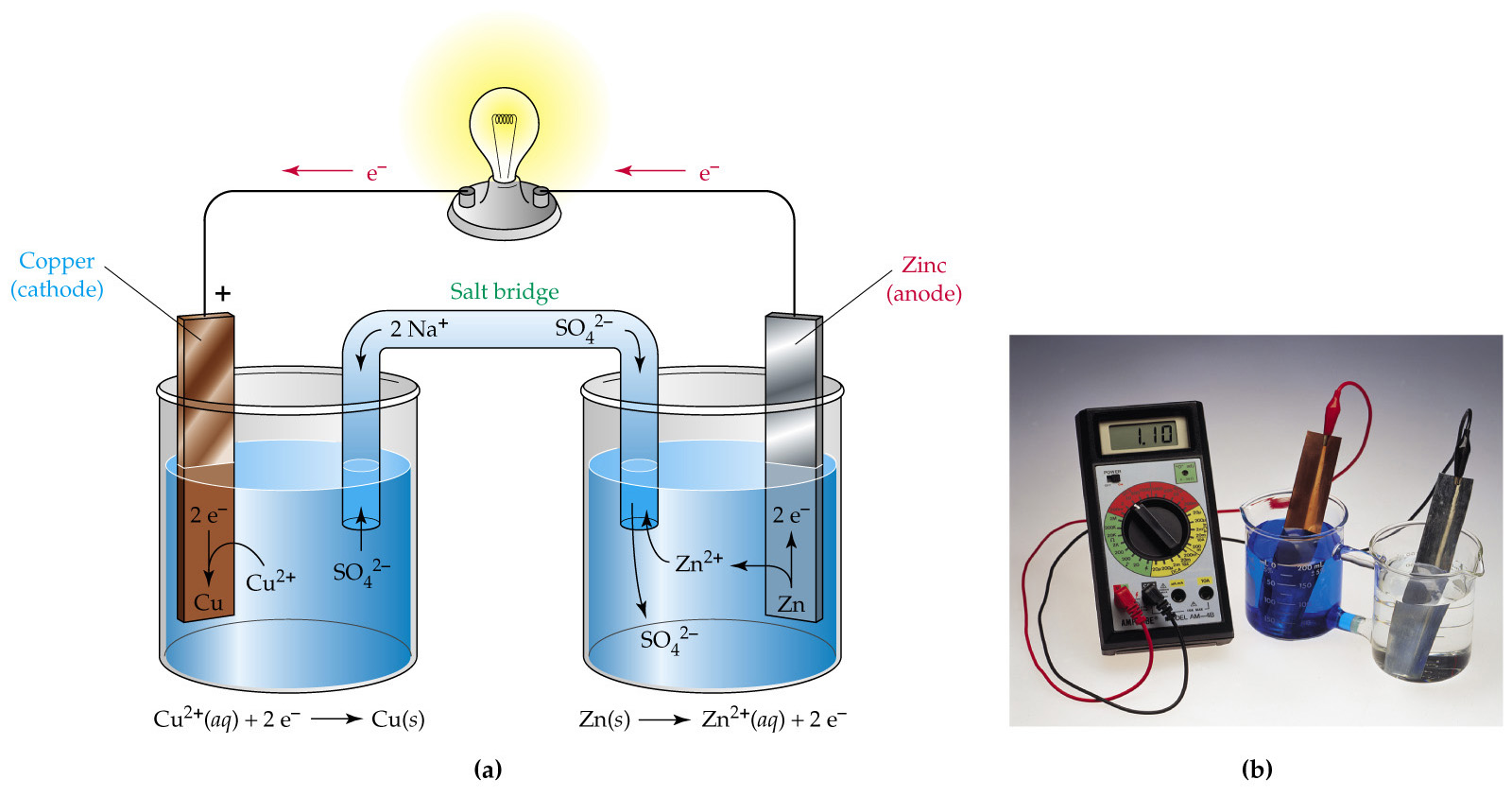
Coulométrie
Définition
La coulométrie est une méthode de l’analyse quantitative. Elle est fondée sur la mesure de la quantité d’électricité nécessaire pour réaliser totalement une réaction électrochimique ou pour préparer un réactif titrant.
Lors d’un dosage coulométrique, la composition de la solution est modifiée par une électrolyse exhaustive.
La coulométrie n’est pas une méthode indicatrice de fin de réaction de titrage.
On destingue:
- La coulométrie directe: où la quantité d’électricite est utilisée pour oxyder ou réduire le corps à doser à l’électrode de travail.
- La coulométrie indirecte (ou titrages coulométriques): où la quantité d’électricité sert à préparer par électrolyse le titrant qui réagit par vois chimique avec le composé à doser.
Mesure Q correspondant à une réaction électrochimique totale
\begin{align}
Red – e^- \leftrightarrow[{Q}][{Q}] Ox
\end{align}
- Coulométrie directe: Mesure de Q
 n e- ; Nb e- /mole Red connus quantité de réducteur Ou connaissant Q et quantité de red nb d’e-
n e- ; Nb e- /mole Red connus quantité de réducteur Ou connaissant Q et quantité de red nb d’e- - Coulométrie indirecte:
X+RRéactif préparé par électrolyse→ Réaction chimique  Déterminer i pour atteindre le point d’équivalence
Déterminer i pour atteindre le point d’équivalence
Loi de Faraday:
Les lois de Faraday relient les quantités de substances obtenues par électrolyse à la quantité de l’électricité Q utilisée pour la réaliser.
Si un ion peut échanger n électronns, une mole d’ions possède n moles d’électrons échangeables soit une charge électrique de nF faradays puisque
![]()
NA étant la constante d’Avogadro et e la charge de la mole d’ions est donc égale à (n x 96490 C).
D’après les lois de Faraday, le nombre de moles d’ions mises en jeu lors de l’électrolyse est ![]() .
.
Le nombre de grammes m de substance oxydée ou réduite est :
![]()
où M est la masse molaire de l’échantillon. Il s’ensuit que la détermination de la quantité d’électricité permet l’obtention de la masse de l’analyte contenue dans la solution.
De même, à partir de la connaissance de Q et de la masse de la substanceélectrolysée, on en déduit la charge de l’espece, ce qui permet de caractériser la réaction électrochimique.
Il apparaît, par comparaison avec un titrage volumétrique, que le passage du courant à travers la solution remplace l’addition du réactif à la burette.
La quantité de substance oxydée exprimée en ions-g ou mole-g est égale à:
![]() ou 1F ou 1 e-g = 96500C
ou 1F ou 1 e-g = 96500C
\begin{align}
m &= \dfrac{1}{F} \cdot \dfrac{M}{n} \cdot Q\\
\text{Nb. milliéquiv} &= \dfrac{t(s) \cdot I(mA)}{96500}
\end{align}
Une même Q d’électricité correspond à la réaction d’un même nb équivalent quelque soit le composé.
Titrage coulométrique
2 étapes:
- Générer le réactif (ex. Ag0) par électrolyse:
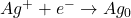 (Cathode: Hg, Pt …)
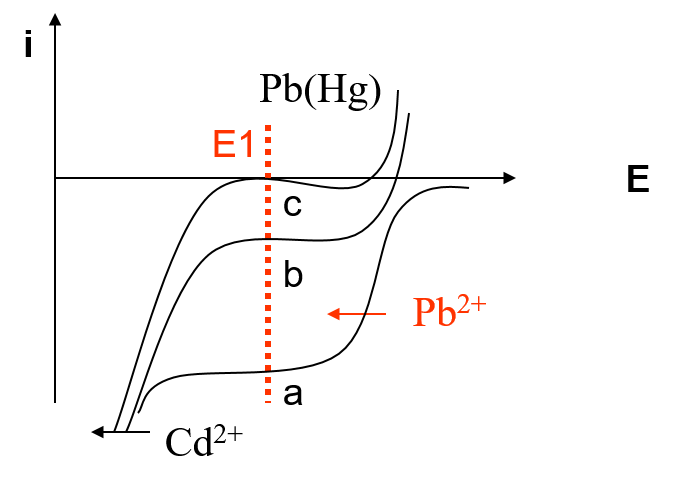
(Cathode: Hg, Pt …) - Ag0 = réactif de Pb2+, Zn2+, Cd2+, …(sans H2)
Autres ex. dosage de X– (non électroactif)
- Générer le réactif (Ag+) par électrolyse
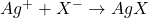
Montage
Préparer Ag0 :
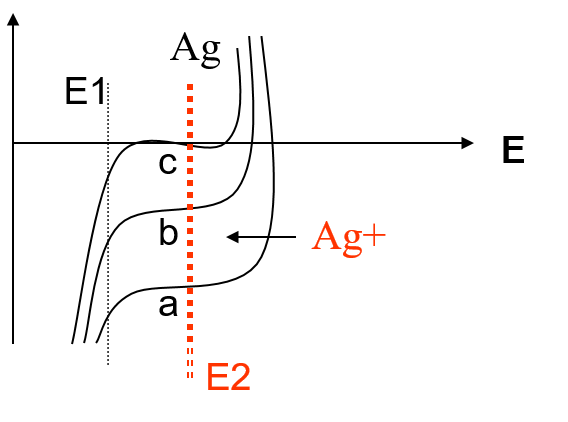
Dosage de Pb2+ en présence de Cd2+ par Ag0 :
Dosages des halogénures X–: Réacif = Ag+
Réaction chimique:
\begin{align}
Ag^+ + X^- \rightarrow AgX
\end{align}
Réaction électrochimique:
\begin{align}
Ag_0 & \rightarrow Ag^+ + e^-\\
X^- + Ag_0 & \rightarrow AgX + e^-
\end{align}
Exemple: Dosage de Br– par coulométrie:
- Réaction chimique:
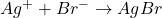
- Générer Ag+ par électrolyse:
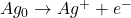
- Réaction électrochimique:
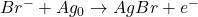
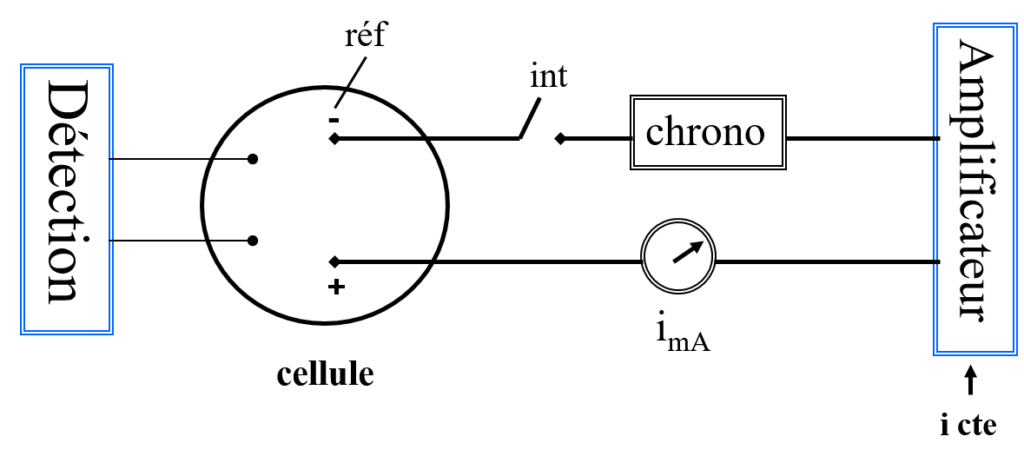
Protocole:
- Cel.1: 20ml HClO4| Cathode Pt| électrode de réference ||pont||Cel.2: 5ml Br- (+)20ml HClO4 |Anode fil d’Argent| électrode indicatrice Ag
- Mesure de E entre l’éléctrode de réferenceet et électrode indicatrice.
- Contrôle de i entre Cathode et Anode
- Mesure de faible quantité de i
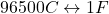 générer 1 Ag+ (échange 1F) Ou il disparaît 1Br– lorsqu’1 e– a été prélevé à l’anode
générer 1 Ag+ (échange 1F) Ou il disparaît 1Br– lorsqu’1 e– a été prélevé à l’anode
NB : générer des réactifs : Acides; bases; Ox; Réd;
Br2; I2; Cl2; Cu+; Ag+ …..
Coulométrie directe à potentiel constant (Ei=cte)
En coulométrie directe, on réduit ou on oxyde directement l’analyte à l’électrode de travail. on opére essentiellement à potentiel imposé
en maintenant le potentiel électrique (exprimé en volts) constant durant la réaction en utilisant un potentiostat .
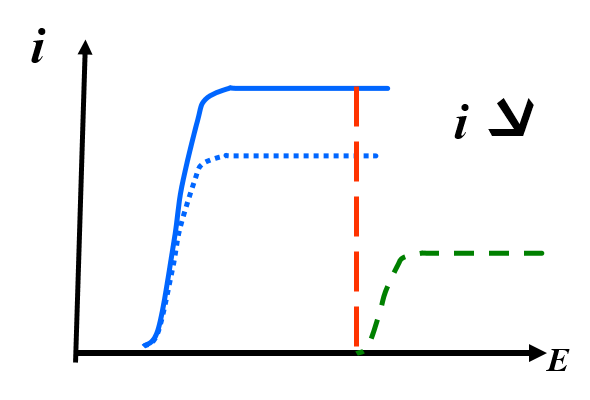
- I = f(E)
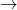 connues
connues - Choix de Ei?
Dans les deux cas, la quantité d’électricité Q ayant traversé le système pendant le temps texp (exprimé en secondes) de l’expérience est exprimée de la manière suivante :
Red1 → Ox1 réduction 100%
- Tracer i = f(t)
- Ou Tracer
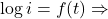 une droite (sur 2 points)
une droite (sur 2 points)
\begin{align}
i &= i_0\cdot e^{-kt} \\
Q &= \int_{0}^{\infty} t : dt \text{ dispositif automatique pour l’intégral}\\
\text{Fin} : i &= i_0\cdot10^{-3}
\end{align}
Coulométrie direct à courant constant (i = cte)
Consiste à maintenir l’intensité du courant (exprimée en ampères) constante en utilisant un ampérostat.
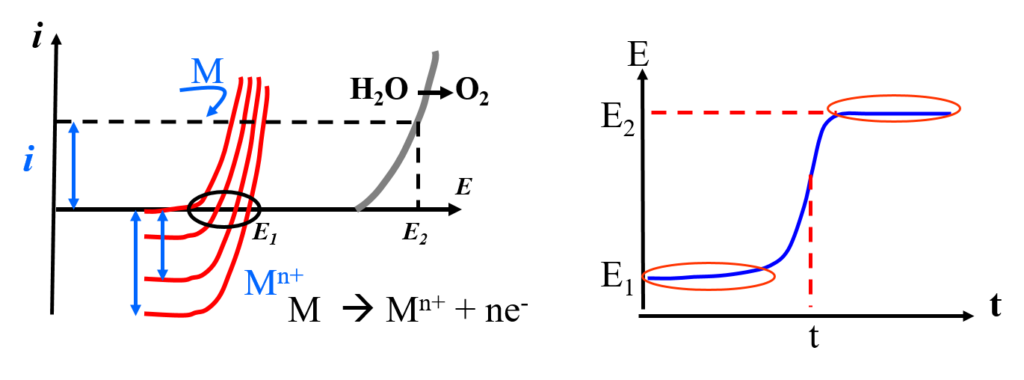
Réduction des oxydes:

Titrage coulométrique mettant en jeu une réaction chimique
A réactif préparé par électrolyse
\begin{align}
B + A &\rightarrow AB \\
C – e^- &\rightarrow A
\end{align}
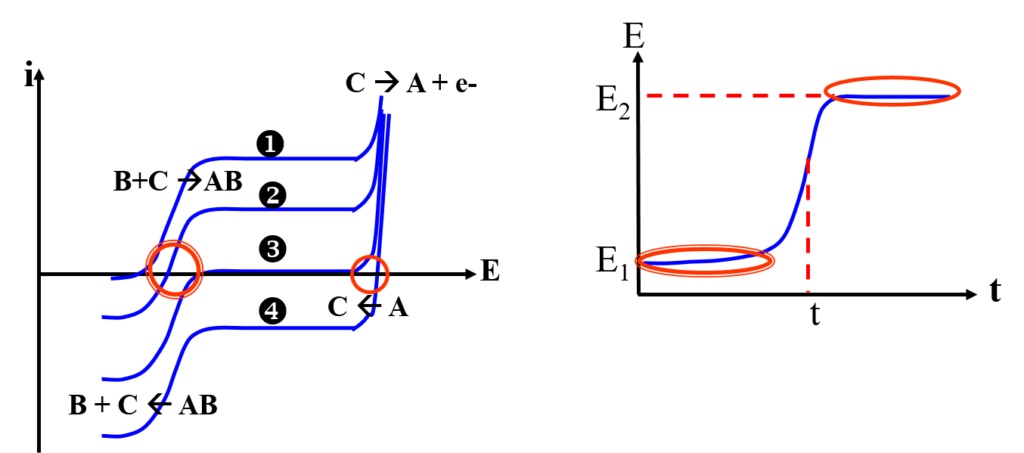
Réactions:
\begin{align}
B + C – e^- & \rightarrow AB \\
C – e^- & \rightarrow A \\
B + A & \rightarrow AB
\end{align}
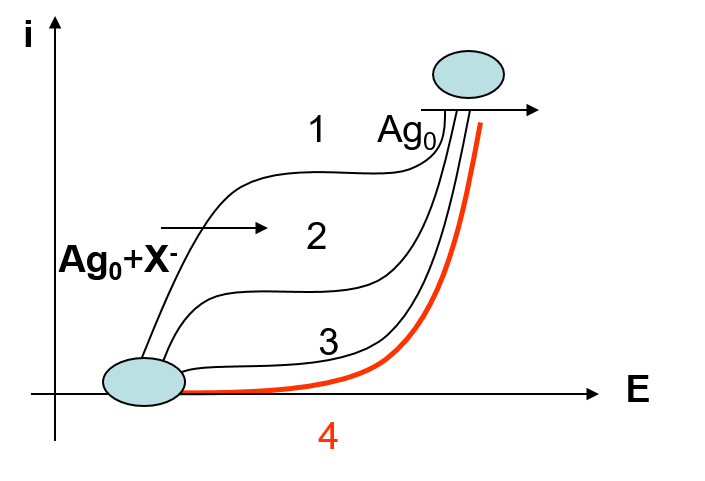
- Courbe 1 & 2 avant point d’équivalence
- Courbe 3 point d’équivalence
- Courbe 4 après point d’équivalence
Au corps à doser B.
on ajoute C en excès
et réaliser l’oxydation de C
Tout se passe comme si on réalisait la réaction:
\begin{align}
B + C – e^- \rightarrow AB
\end{align}
NB :
Fe2+ (solution) ? Son oxydation permet de préparer Fe3+
Mais peu utilisée car il arrive un moment où iFe devient
inférieure à i imposée; à ce moment d’autres corps sont oxydés.
Remède: imposer (i) très faible (mais opération trop longue).
![]() Fe3+ :
Fe3+ :
- Réactif de complexe EDTA (Fe2+ ne réagit pas sur FeY–)
- Réactif de redox Ce3+
Applications
- Dépôt de M : Ag+, Pb2+ , Cd2+, Zn2+ (mélange Pb2+, Cd2+)
- Oxydation et réduction de système soluble : Fe2+ Coulométrie de corps non électroactif : (système oxydoréducteur complexe)
- Dosage de X–
- Dosage EDTA (i = 0 lorsque Y4- = 0)
- Dosage retour (on dose l’excès du réactif par coulométrie)
Caractéristiques
- Initialement limité au corps électroactif
- Sélectivité : choix de E
- Sensibilité : limitée par l’importance et la reproductibilité de iR
- Précision : dépend de la précision sur la détermination de Q:
(1)
- Q totale: Mesurée pendant l’électrolyse du corps à doser
- Q résiduelle: Consommée dans les mêmes conditions en l’absence de sub
Exercice (Ampérométrie)
Un échantillon contenant un mélange de Pb2+ et Ba2+ :
Les deux ions précipitent sous forment de Chromate.
Ps (BaCrO4) = 10-13,4 , Ps(PbCrO4) = 10-9,9
Sachant que Ba2+ est non électroactif, Tracer la courbe de dosage ampérométrique qui permet le titrage successif de Pb2+ et Ba2+.
On donne:
- Pb2+/Pb: E0 = – 0,13 V
- Hg2+/Hg: E0 = – 0,00 V
- Cr2O72-/Cr3+: E0 = – 0,21 V
Share this content:
Table des matières