Spectrométrie de masse
Principe
- La Spectrométrie de masse repose sur l’ionisation et la fragmentation des molécules.
- L’ionisation entraîne une accumulation d’énergie qui, en se dissipant, provoque la rupture des liaisons donnant des fragments caractéristiques de la molécule.
- Accélération des fragments puis l’analyseur les sépare en fonction du rapport masse /charge (m/z).
- Établissement d’un spectre caractéristique appelé spectre de masse.
Description des étapes
- Ionisation: l’échantillon étudié est vaporisé et ionisé dans la source par différents procédés. À ce stade on obtient un mélange d’ions de fragmentation.
- Accélération: les ions formés, sont extraits de la source, focalisés et accélérés.
- Séparation: les ions sont filtrés suivant leur rapport m/z par un ou plusieurs analyseurs.
- Détection: après séparation, les ions terminent leur course en venant frapper un détecteur qui détecte et amplifie le courant ionique très faible.
- Affichage du spectre de masse.
Appareillage
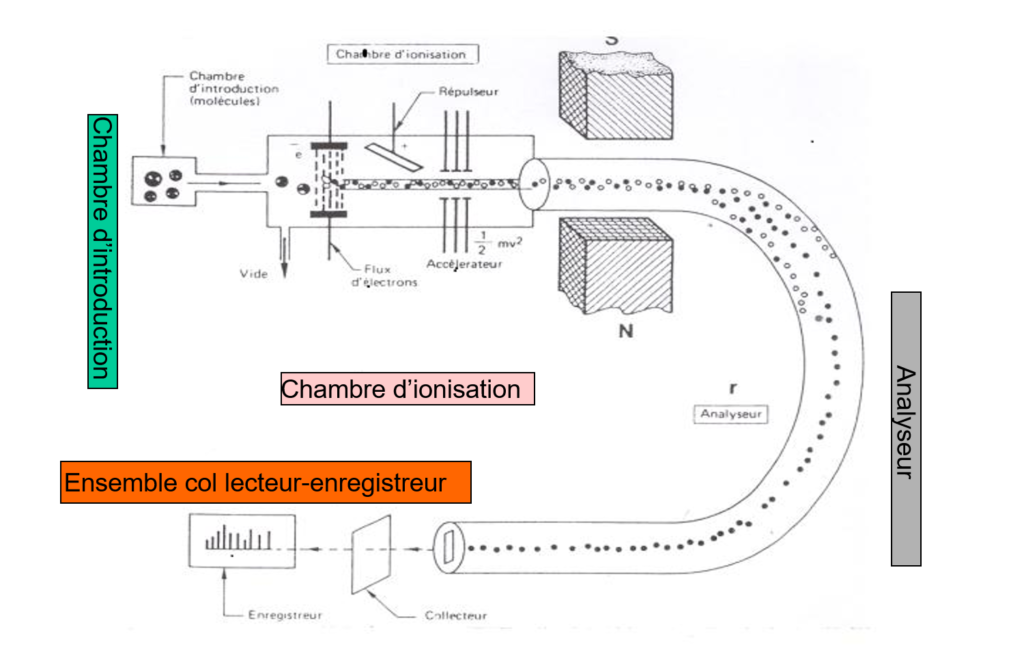
- Introduction de l’échantillon: (µg) Gaz (microfuite); – Solide et liquide: volatilisation (vide et chauffage); Système de pompage provoque l’écoulement de la vapeur.
- Chambre d’ionisation: où a lieu l’ionisation des molécules et la fragmentation des ions; souvent commune à tous les appareils, avec différents modes d’ionisation. Plusieurs procédés peuvent être utilisés.
- Analyseur (ou système dispersif):
- Séparation des ions suivant: m/z.
- Analyseur diffère d’un appareil à l’autre.
- Détecteur: Mesure l’abondance relative de chaque ion. À chaque signal correspond un faisceau d’ions dont le rapport m/z est différent. Cet enregistrement est appelé: Spectre de masse
Différents types d’ionisation
Méthodes d’ionisation conventionnelle
Ionisation par bombardement d’électrons:
Procédé ancien; un flux d’électrons dont l’énergie quelques eV à 100 eV est émis par un filament chauffé (rhénium (Re) ou tungstène (W)). Ces électrons sont accélérés par variation de potentiel, attirés perpendiculairement par une anode.
Le bombardement de l’échantillon gazeux sous vide provoque une augmentation de l’énergie des molécules suivie d’ionisations et fragmentations en ions (anions et cations) et molécules neutres.
Avantages:
- Flux d’électrons d’intensité bien contrôlée;
- Fragmentation importante (70eV) donnant une véritable fiche d’identité à l’échantillon. Signal du pic moléculaire très faible.
Inconvénients: Spectres trop chargés.
- molécules excitées: (E > 70 eV): \begin{align}M + e^- \longrightarrow M^\ast + e^-\end{align}
- ions positifs par expulsion d’1 ou 2 e-: (E ~ 20 – 70 eV)\begin{align}M + e^- &\longrightarrow M^{+\bullet} + 2 e^-\\ \; M + e^- &\longrightarrow M^{2+} + 3 e^- \end{align}
- ions négatifs par capture d’un e- : E < 1 eV . AB + e^- \longrightarrow AB^- (moins probable)
- Fragmentation: Énergie d’ionisation est de l’ordre de 6 à 12 eV.
Les M^{+\bullet} dissipent leur excès d’énergie interne en se fragmentant pour donner ions et espèces neutres. On obtient:
Fragmentations = (Réactions unimoléculaires)
\begin{align}
M + 1e-\longrightarrow[K_1]M^{+\bullet} + 2 e^-
\longrightarrow N^{\bullet} + M^+\\
ABC +1e^- \longrightarrow ABC^{+\bullet} + 2 e^- \\
K_2 \longrightarrow BC^{\bullet} + A^+ \\
K_2^{\prime} \longrightarrow A^{\bullet} + BC^+ \\
C^{\bullet} + AB^+ \\
BC^+
\longrightarrow[K_3]
B^+ + C^{\bullet} \text{ ou } (A^+ + B^{\bullet})
\end{align}
Rupture des liaisons: ({K_1}; {K_2}; {K_3} = constantes de vitesse)
K est associée à la notion de temps: [/latex]k = \dfrac{1}{t}[/latex]
| ionisation | 10-16 s | 10-2s |
| t d’une vibration | 10-14 s | 1 s |
| t [/latex]\rightarrow[/latex] Collecteur | 10-6 s | 80 ans |
Ions = systèmes isolés: Ex. vie d’un ion:
*Courbes : (M+) = f(t) exponentielle (avec ctes de vitesse K1; K2; K3 )
*![]() différentes selon:
différentes selon:
- Rupture (rapide; E grande)
ou – réarrangement (lent; E faible)

Ionisation chimique
- Les molécules gazeuses de l’échantillon à analyser sont introduites dans la chambre d’ionisation en même temps qu’un gaz réactif (CH4, isobutane, NH3…).
- Un faisceau d’électrons bombarde les molécules et du fait des très faibles concentrations de l’échantillon, seules les molécules du gaz sont ionisées et fragmentées.
- Les fragments très réactifs ainsi formés réagissent à leur tour sur les molécules de l’échantillon et provoquent leur ionisation.
Exemple 1: CH4:
(1) 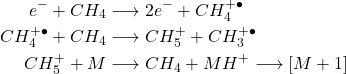
Autres réactions radicalaires:
\begin{align}
CH_4^{+\bullet} &\longrightarrow CH_3^+ + H^{\bullet} \text{ puis } CH_3^+ + CH_4 \longrightarrow C_2H_5^+ + H_2 \\
CH_4^{+\bullet} &\longrightarrow CH_2^{+\bullet} + H_2
\end{align}
Exemple 2: NH3
\begin{align}
e^- + NH_3 &\longrightarrow {2} e^- + NH_3^{+\bullet}\\
NH_3^{+\bullet} + NH_3 &\longrightarrow NH_4^+ + NH_2^{\bullet}\\
NH_4^+ + M &\longrightarrow NH_3 + MH^+ \; \longrightarrow M + 1 \text{ ou} \\
NH_4^+ + M &\longrightarrow [M + NH_4]^+\; \longrightarrow M + 18
\end{align}
Méthodes d’ionisation douce (directe)
Dans l’Impact électronique et l’ionisation chimique: l’ionisation est réalisée en phase gaz (après volatilisation sous l’effet chaleur + vide).
Si composés polaires, peu volatiles ou fragiles, risque de dégradation d’où remède = fournir beaucoup d’énergie en un temps bref = phénomène d’ionisation évaporation simultanées avec un transfert rapide d’énergie = désorption.
Désorption par effet de champ (FD)
Dépôt de l’échantillon en solution sur une électrode recouverte d’aiguilles de Carbone (W ; Re), et placée dans un champ E très puissant (108 V.cm-1). On chauffe jusqu’à la fusion de l’échantillon. Il y a désorption.
Avantages: Possibilité d’analyser des substances solides, peu volatiles ou thermolabiles ( sucres, acides … )
bombardement d’atomes accélérés (FAB)
L’échantillon, dispersé à l’état solide, dans une matrice liquides (ex glycérol). Les atomes accélérés d’Ar ou de Xe (103 V) bombardent l’échantillon. provoquant une ionisation douce.
Avantages: ![]() de masse très élevée (40 000 u.m.a: ex les peptides).
de masse très élevée (40 000 u.m.a: ex les peptides).
Ionisation par laser (MALDI)
L’échantillon est mélangé avec une matrice solide. Un laser pulsé provoque désorption et ionisation.
(matrice = vecteur d’énergie entre le laser et les molécules de l’échantillon.)
Avantages: ![]() non volatiles, thermolabiles et de haut PM nécessitant une ionisation douce.
non volatiles, thermolabiles et de haut PM nécessitant une ionisation douce.
Electrospray (ESI: électronébulisation)
C’est le procédé le plus doux (Pression atmosphérique, Température ambiante).
L’échantillon est dissout dans une solution (méthanol-eau 50/50 ou acétonitrile-eau). La solution est introduite dans la source par un capillaire très fin . Sous l’action d’un gaz nébuliseur (N2) et celle d’un champ électrique intense , on crée un fin brouillard (spray) de gouttelettes polychargées.
Évaporation du Solvant (taille goutte diminue et charge augmente).
Quand la répulsion coulomb excède la tension superficielle, chaque goutte éclate en plusieurs gouttes filles etc…jusqu’à la désorption par effet de champ et l’obtention d’ ions multichargés de faible énergie interne. (analyse des protéines)
Ions métastables: – Se fragmentent dans le tube courbé (après la source); – Durée de vie courte (pas la bonne Ec)
- Ces ions sont très utiles pour déterminer la filiation Ex: Si 1 ion parent M1 se décompose en 1 fragment neutre et 1 ion de masse M2; s’il existe 1 ion métastable M* dans cette filiation, il aura pour masse:
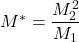
Share this content:
Table des matières