Potentiométrie
Introduction
La potentiométrie est une technique d’analyse électrochimique qui permet de relier une mesure de potentiel d’électrode à une activité d’espèce en solution. L’électrode correspondante est appelée électrode indicatrice. L’électrode indicatrice (de potentiel Eind), choisie en fonction de la nature du soluté à déterminer, est incluse dans une chaîne galvanique comportant une électrode de référence (de potentiel Eref) et un ou deux électrolytes. Selon qu’il y a un ou deux électrolytes, la chaîne potentiométrique peut être écrite :
Eref / Électrolyte /Eind ou Eref / Électrolyte 1 /Électrolyte 2 /Eind
Aspects théoriques
Définition
Les indications des différents types d’électrodes indicatrices sont exploitées soit pour relier directement le potentiel lu à la concentration du (ou des) solutés grâce à un étalonnage préalable (dosages potentiométriques), soit pour déterminer une quantité de substance par l’intermédiaire d’une réaction chimique (titrages potentiométriques).
Selon les conditions opératoires on distingue deux grands types de mesure potentiométrique :
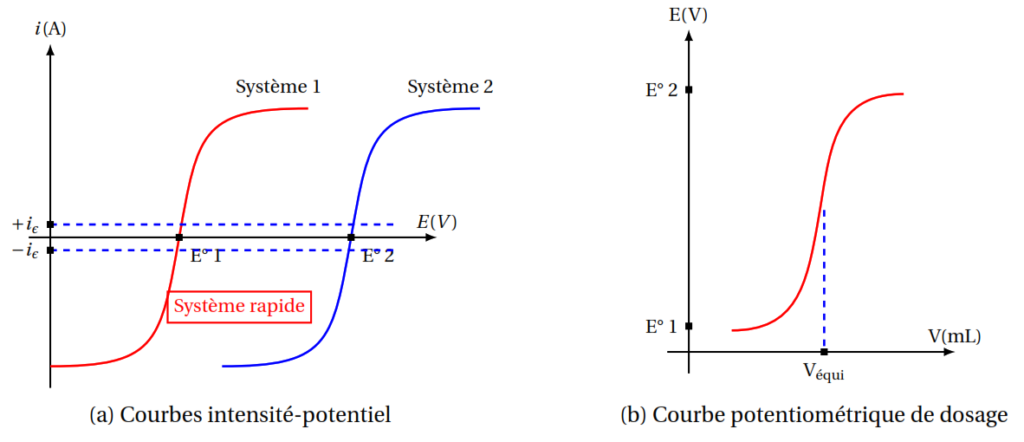
La potentiométrie à courant nul, à une électrode indicatrice (et une électrode de référence) ou à deux électrodes indicatrices %(en général de nature différente) ; utilisée pour les systèmes rapides
La potentiométrie à courant imposé, à une électrode indicatrice (et une électrode de référence) ou à deux électrodes indicatrices %(le plus souvent de même nature), utilisée à la fois pour les systèmes rapides et lents
Potentiométrie directe
On appelle dosage potentiométrique, ou encore potentiométrie directe, toute méthode de détermination de concentration fondée sur l’exploitation de la relation de Nernst reliant le potentiel d’une électrode à l’activité de l’espèce en solution.
Elle permet le dosage d’ions, de molécules de gaz ou des molécules biologiques par des électrodes à %membrane
sélectives.
Potentiométrie indirecte
Un titrage consiste à mesurer la concentration d’une espèce dans une solution inconnue, par l’intermédiaire d’une réaction chimique. Lorsque la méthode instrumentale utilisée pour suivre l’avancement de la réaction est une mesure de potentiel, on effectue un titrage potentiométrique.
C’est une méthode d’indication potentiométrique au cours de réactions chimiques de dosage en solution. La détermination du point équivalant permet de calculer la concentration du soluté (un ion, ou molécule).
Méthodes:
Potentiométrie à i = 0 : systèmes rapides
Potentiométrie à i = cste ![]() 0 : systèmes rapides et lents
0 : systèmes rapides et lents
( ![]() ).
).
Variation des potentiels lors des dosages par potentiométrie indirecte
Les potentiels mesurés
Potentiel redox : Potentiel d’oxydo-réduction
Métal – ion métallique
Électrode de métal M plongée dans une solution d’ions M+.
\begin{align*} E &= E^0 + \dfrac{RT}{nF} \cdot \ln a(M^+) = E^0 + \dfrac{0,059}{n} \cdot \log a(M^+) \\ \text{Exemple:} Ag^+ / Ag_0:&\\ Ag^+ + 1 e^- &\rightleftharpoons Ag_0 \quad E = E^0_{Ag^+ / Ag_0} + 0,059 \cdot \log a(Ag^+) \end{align*}
Métal – sel insoluble du métal
\begin{align*} E &= E^{0} – \dfrac{RT}{nF} \ln a (X^-) = E^{0} – \dfrac{0,059}{n} \log a (X^-) \qquad E^{\prime 0} \text{ dépend du Ps}\\ \text{Exemple} : Ag/AgCl&\\ AgCl + 1 e^- &\rightleftharpoons Ag_0 +Cl^- \qquad E = E^{0}_{Ag/AgCl} – 0,059 \log [Cl^-] \end{align*}
Couple redox soluble – métal inattaquable
Potentiel d’équilibre
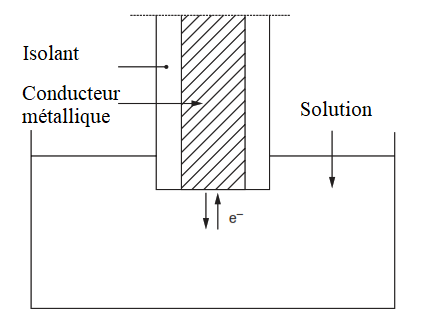
Une électrode supposée inattaquable dans les conditions de la mesure (platine, or, iridium, etc.) plongée dans une solution contenant un oxydant et un réducteur du même couple électrochimique tel que :
\begin{align} \alpha Ox + ne^- \rightleftharpoons \beta Red \end{align}
adopte, dans le cas d’un système réversible (rapide), et à courant nul, le potentiel calculable par la formule de Nernst :
\begin{align*} E &= E^0 + \dfrac{RT}{nF} \ln \dfrac{a (Ox)^{\alpha}}{a (Red)^{\beta}}=E^0 + \dfrac{0,059}{n} \log \dfrac{a (Ox)^{\alpha}}{a (Red)^{\beta}} \end{align*}
avec:
[a(Ox):] activité de l’oxydant (mol.L-1) ,
[a(Red):] activité du réducteur (mol.L-1)
[E0:] potentiel normal du couple Ox/Red (Volt) .
Le potentiel E mesuré, appelé potentiel d’équilibre et symbolisé par Eeq , est illustré en figure suivant pour le système électrochimique Fe3+/Fe2+.
Lorsqu’on plonge une électrode de platine dans une solution du mélange Fe3+ et Fe2+, bien qu’elle ne soit parcourue par aucun courant mesurable, on montre qu’au niveau de l’interface électrode-solution, il existe :
- un courant d’échange d’électrons entre l’oxydant et le réducteur par l’intermédiaire du conducteur électronique (platine) soit :
- Ian (courant anodique) pour la réaction :
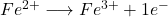
- Icat (courant cathodique) pour la réaction :
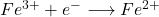
- un courant résiduel Ires correspondant essentiellement à l’électrolyse d’impuretés (dont l’oxygène résiduel)
\begin{equation}E_{eq} = E^0_{(Fe^{3+}/Fe^{2+})} + 0,059 \log \dfrac{[Fe^{3+}]}{[Fe^{2+}]}\end{equation}
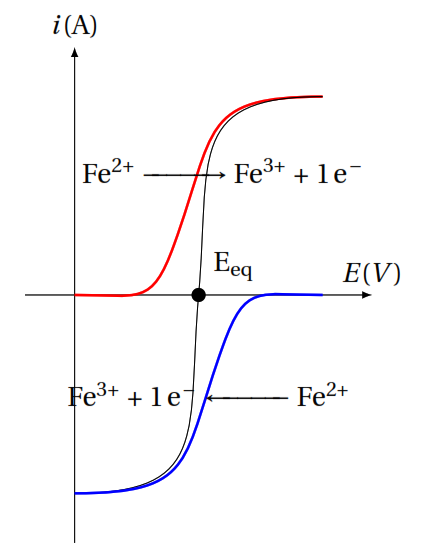
Potentiel mixte :
Lorsque la solution comporte un oxydant et un réducteur appartenant à deux systèmes électrochimiques differents, une électrode plongé dans cette solution adopte un potentiel mixte.
Potentiel limite :
Ex système rapide : l’un des constituants est à concentration faible jusqu’à l’équivalence.Potentiel de membrane
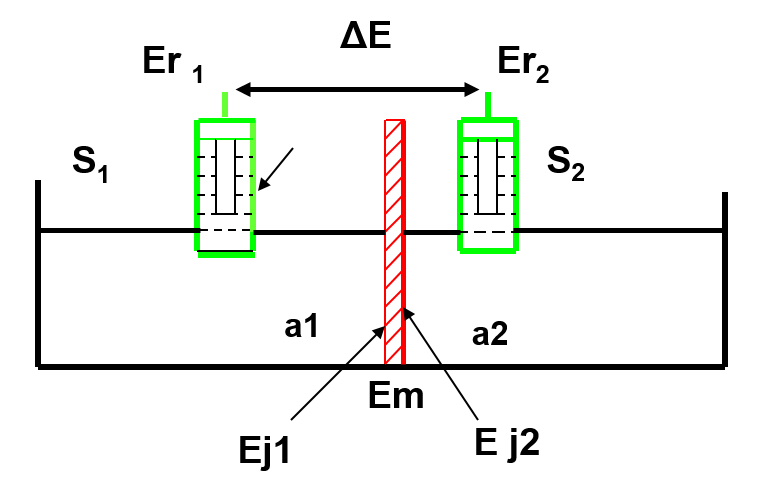
Potentiel de membrane
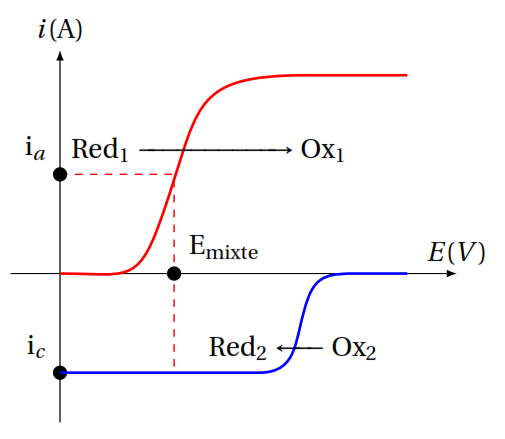
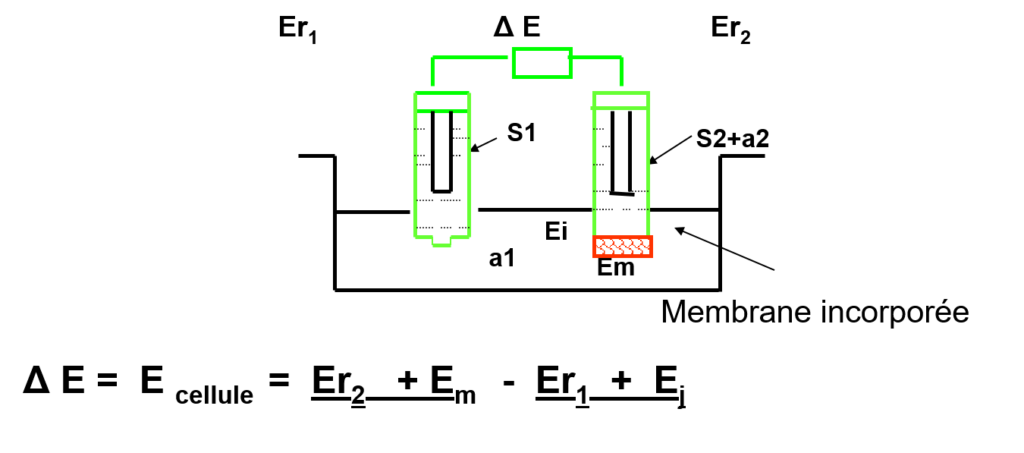
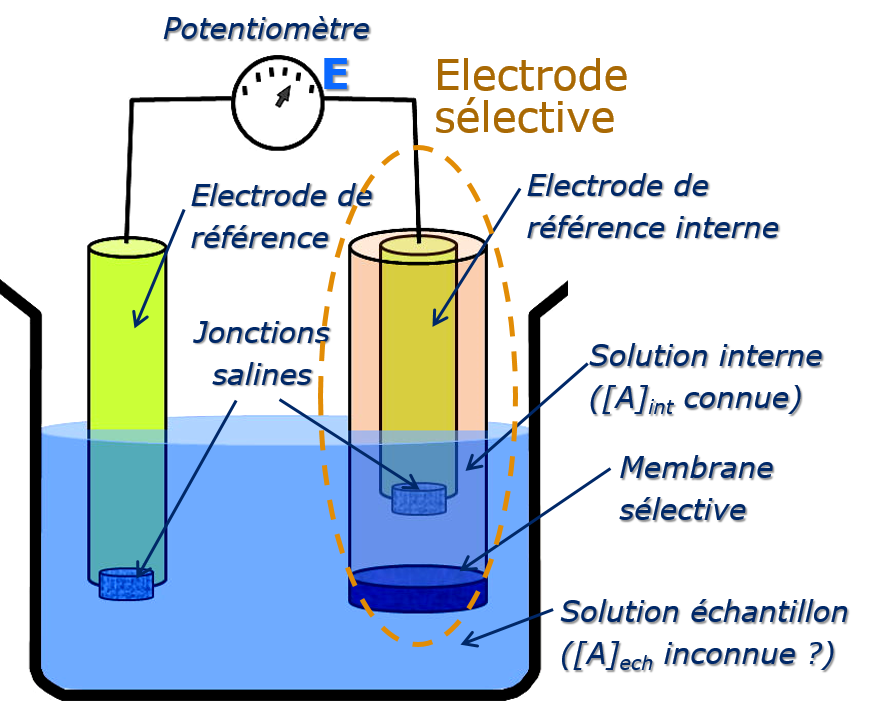
Alors que la mesure d’un potentiel d’oxydoréduction est réalisée par mise à l’équilibre d’une interface conducteur électronique-solution, celle d’un potentiel de membrane s’effectue en interposant entre la solution inconnue et une solution de référence une membrane sélective conductrice ionique. En réalisant une chaîne galvanique telle que :
Électrode de référence interne|Solution 1(ai)1||Membrane||Solution 2 (ai)2|Électrode de référence externe
Il se développe de part et d’autre de la membrane un potentiel dont la théorie montre qu’il est relié à la différence des activités de l’espèce i dans les deux solutions 1 et 2 qui baignent la membrane.
On a :
\begin{align}\Delta E = \dfrac{0,059}{z} \log \dfrac{a_{i1}}{a_{i2}} \end{align}
avec z: charge de l’ion (en valeur algébrique) auquel la membrane est sensible.
En maintenant constante l’activité de l’ion d’un côté de la membrane, on relie directement la mesure de potentiel à l’activité de l’ion dans la solution inconnue.
Le potentiel mesuré aux bornes de la chaîne galvanique de la figure précédente est de la forme :
\begin{align}E_m = E^{\prime} + \dfrac{0,059}{z} \log a_{i2}\end{align}
E’ peut être assimilé à des paramètres caractérisant le dispositif expérimental de mesure. Il regroupe en effet un ensemble de termes de potentiel, constants pendant la mesure (potentiels normaux des électrodes de référence, potentiel de jonction ionique etc.).
Selon la nature physico-chimique de la membrane, on distingue deux grandes classes d’électrodes : celles à membrane cristalline (solides) et celles à membrane échangeuse d’ions non cristallines (liquides).
Em : dû à la différence d’activités a1 et a2 en ions X
(1) 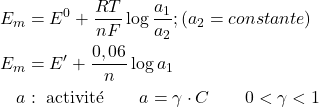
![]() : Si la solution est diluée, de force ionique constante (ion inerte).
: Si la solution est diluée, de force ionique constante (ion inerte).
Appareillage
Dispositif expérimental
Comme le montre la figure suivante le montage contient essentiellement:
- Électrode de référence
- Électrode indicatrice
- Potentiomètre
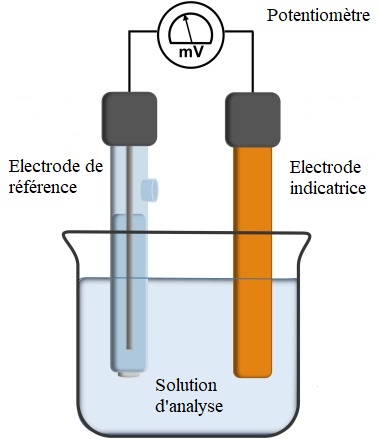
Les électrodes
Électrodes de référence
Ce sont des demi-cellules correspondant à des systèmes électro-chimiques réversibles et dont le potentiel reste invariable quelle que soit la composition en solutés de la solution dans laquelle elles sont plongées. Elles incluent une jonction ionique qui sert d’interface entre la solution de remplissage interne et la solution à analyser dans laquelle elles sont plongées. L’utilisation d’une électrode de référence permet de mesurer le potentiel d’électrode indicatrice dans une solution. Par convention, dans l’eau, l’échelle des potentiels est rapportée à l’électrode normale à hydrogène prise comme origine.
Mais la mise en œuvre d’une telle électrode présentant quelques difficultés, d’autres électrodes, dites de comparaison (et par extension de référence) sont utilisées couramment.
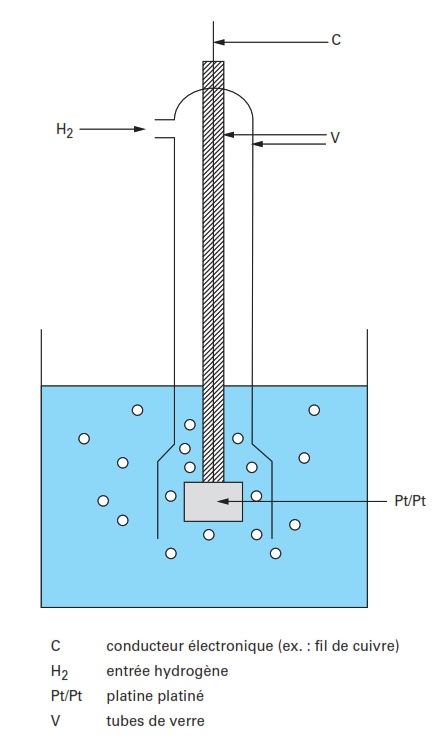
Électrode normale d’hydrogène (ENH)
Elle est basée sur la mesure du potentiel d’oxydoréduction du couple H+/H2 , à une électrode inattaquable (platine, palladium, etc.) dans des conditions de réversibilité thermodynamique. Bien que les électrodes polies de platine, palladium, iridium puissent être utilisées pour constituer une électrode à hydrogène, on préfère en général recouvrir ces électrodes d’une couche du même métal, divisé, ce qui a pour effet d’augmenter considérablement la cinétique électrochimique et donc la réversibilité du système.
Ainsi, le plus couramment, on recouvre le platine de platine divisé, déposé électrochimiquement par réduction d’une solution d’acide chloroplatinique : on dispose alors d’une électrode de platine platiné.
Dans la mesure où l’activité des ions H+ et la pression partielle d’hydrogène sont constantes, le potentiel E de l’électrode est invariable : c’est une électrode de référence de potentiel.
En pratique, on opère en milieu acide fort concentré (1 M) et sous pression constante d’hydrogène (1 atm) réalisée par un barbotage constant de ce gaz autour d’une lame de platine platiné. On dispose alors d’une électrode normale à hydrogène.
\begin{align} 2H^+ + 2e^- &\rightleftharpoons H_2& E^\circ &= 0 V\\ [H^+] &= 1 M \qquad P(H_2) =1 atm & E &= 0,06\cdot \log \dfrac{[H^+]}{\sqrt{P(H_2)}} = 0 \end{align}
Le dispositif le plus simple est représenté dans la figure suivante. Elle présente un potentiel nul à toutes les températures. Elle est très peu utilisée (n’est pas pratique).
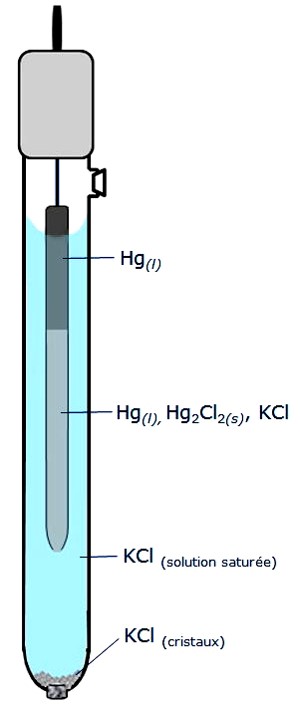
Électrode au calomel saturé (ECS)
C’est une des électrodes de référence de potentiel le plus couramment utilisée. Elle est constituée du mélange mercure-chlorure mercureux (calomel) mis au contact d’une solution de chlorure de potassium de concentration connue et constante (par exemple, 3 M ou saturée). Le système électrochimique réversible est :
\begin{align}Hg_2Cl_2↓ + 2e− \rightleftharpoons 2Hg↓ + 2Cl^−\end{align}
(la flèche ↓ signale le caractère condensé, solide ou liquide, de l’espèce), auquel correspond la relation de Nernst :
\begin{align} E_{Hg_2Cl_2/Hg} &= E^0_{Hg_2Cl_2/Hg} +2,3 \dfrac{RT}{F} lg \dfrac{1}{(a_{Cl^-})^2}= constante \end{align}
\begin{align} Hg_2^{2+} +2e^- &\rightleftharpoons {2} Hg_0\\ Hg_2Cl_2 &\rightleftharpoons {2} Cl^- + Hg_2^{2+}\\ Hg_2Cl_2 +2e^- &\rightleftharpoons {2} Hg_0 + 2Cl^- \\ Ps &= [Hg_2^{2+}] [Cl^-]^2 \\ E_{Hg_2Cl_2/Hg} &= E^0_{Hg_2Cl_2/Hg} – 0,06 \cdot \log [Cl^-] \\ E_{Hg_2Cl_2/Hg} &= E^0_{Hg^{2+}/Hg} +\dfrac{0,06}{2}\cdot \log Ps \\ E &= 0,244 V /\text{ ENH} \end{align}
\begin{align} Hg_2Cl_2 \qquad Ps &= 1,32.10^{-18} \text{à }25°C \\ C_{KCl} = 0,1 mol/L &\Rightarrow E_{\text{électrode}} = 0,320 V\\ \text{Solution saturée en } KCl &\Rightarrow E_{\text{électrode}} = 0,248 V \end{align}
Électrode au sulfate mercureux Hg2SO4
L’électrode de référence « au sulfate mercureux » correspondant au système Hg, Hg_2SO_4} , K_2SO_4} (saturé) de E = 0,682 V /ENH .
Même principe que l’ECS; elle remplace ECS en milieu Ag+ , l’électrode de référence « au sulfate mercureux » correspondant au système Hg, Hg2SO4, K2SO4(saturé) . E = 0,682 V /ENH
Remarque : Compte tenu des contraintes environnementales concernant l’utilisation du mercure, les électrodes de référence au calomel sont désormais très souvent remplacées par le système argent-chlorure d’argent.
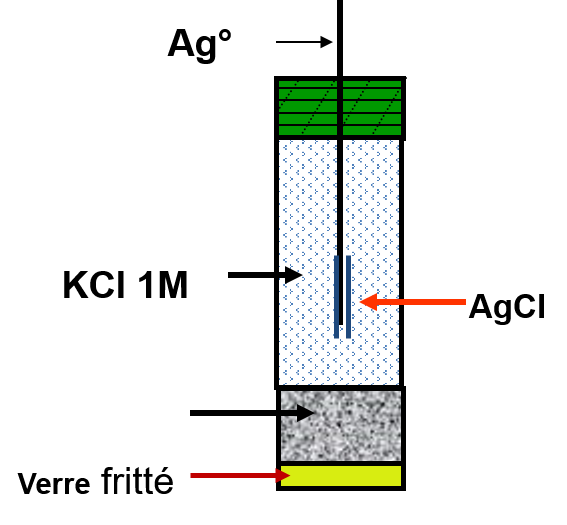
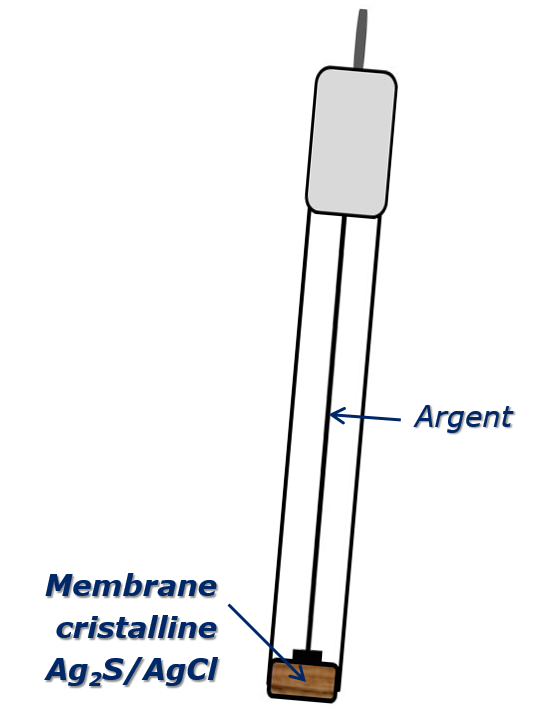
Électrode argent-chlorure d’argent
Cette électrode dont le potentiel est très reproductible est facile à préparer. Elle constitue très souvent l’élément de référence interne des électrodes de verre. Cette électrode est aisément réalisée en plongeant dans une solution de chlorures, dont l’activité est connue et constante, un fil d’argent sur lequel a été déposé du chlorure d’argent par un procédé chimique ou électrochimique.
Pour l’équilibre électrochimique réversible:
(2) ![]()
On a :
\begin{align} E_{AgCl/Ag} &= E^0_{AgCl/Ag} +2,3 \dfrac{RT}{F} lg \dfrac{1}{a_{Cl^-}}= constante \end{align}
à condition de fixer l’activité des ions chlorures en solution.
![]()
\begin{align} C_{KCL} = 1 mol/L &\Rightarrow E_{\text{électrode}} = 0,22 V\\ \text{Solution saturée en } KCl &\Rightarrow E_{\text{électrode}} = 0,197 V \end{align}
\begin{align} E_{AgCl/Ag} &= E^0_{AgCl/Ag} – 0,06 \log [Cl^-] \\ \text{Si } [Cl^-] = 1M \\ \Longrightarrow E_{AgCl/Ag} &= E^0_{AgCl/Ag} = E^0_{Ag+/Ag} + 0,06 \log Ps\\ 0,22 V /\text{ENH à } 25°C \end{align}
Remarque : compte tenu des contraintes environnementales concernant l’utilisation du mercure, les électrodes de référence au calomel sont désormais très souvent remplacées par le système argent-chlorure d’argent (certains constructeurs ne commercialisent d’ailleurs plus d’électrodes au calomel).
Électrodes indicatrices
Électrodes redox
Métal / ion métallique :
Les électrodes constituées d’un métal M sont directement sensibles à la concentration des ions du même métal (couple redox Mn+/M).
Ag+/Ag0
\begin{align} E = E^0 + \dfrac{0,06}{n}\cdot log a (Ag^+) \end{align}
Associée à une électrode de référence, le potentiel mesuré de la cellule est :
![]()
L’une des applications de l’électrode d’argent est le suivi potentiométrique des réactions de précipitation par argentimétrie.
(Potentiométrie indirecte) Example : Dosage I–, Cl–, Br–
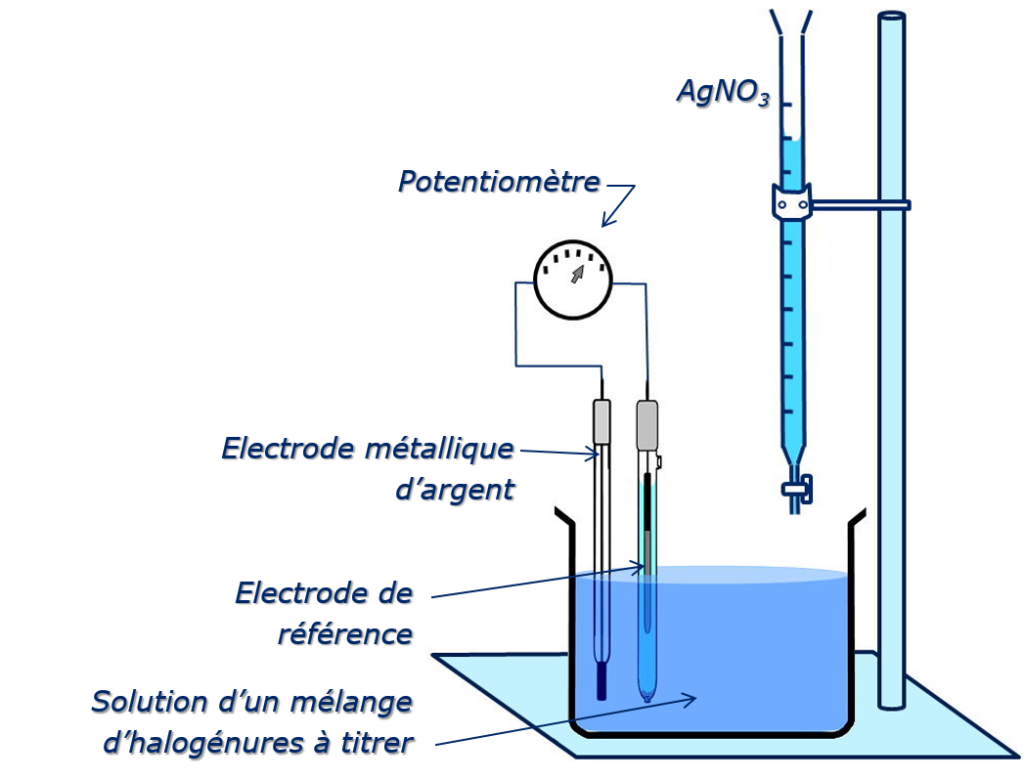
Métal inerte (inattaquable)
Ce sont des électrodes constituées d’un métal (noble) inattaquable (Platine, Or..) ou du carbone vitreux. Dans une solution de couple redox :
Exemple : Electrode Redox en platine
L’électrode de platine plongée dans une solution contenant les deux espèces oxydante et réductrice solubles d’un couple redox prend directement le potentiel donné par l’équation de Nernst appliquée au couple en question :
\begin{align} E = E^0 + \dfrac{0.06}{n} \log \dfrac{a(Ox)}{a(Red)} \end{align}
Dosage du Fe2+ par le Ce4+ avec détermination potentiométrique du point d’équivalence.
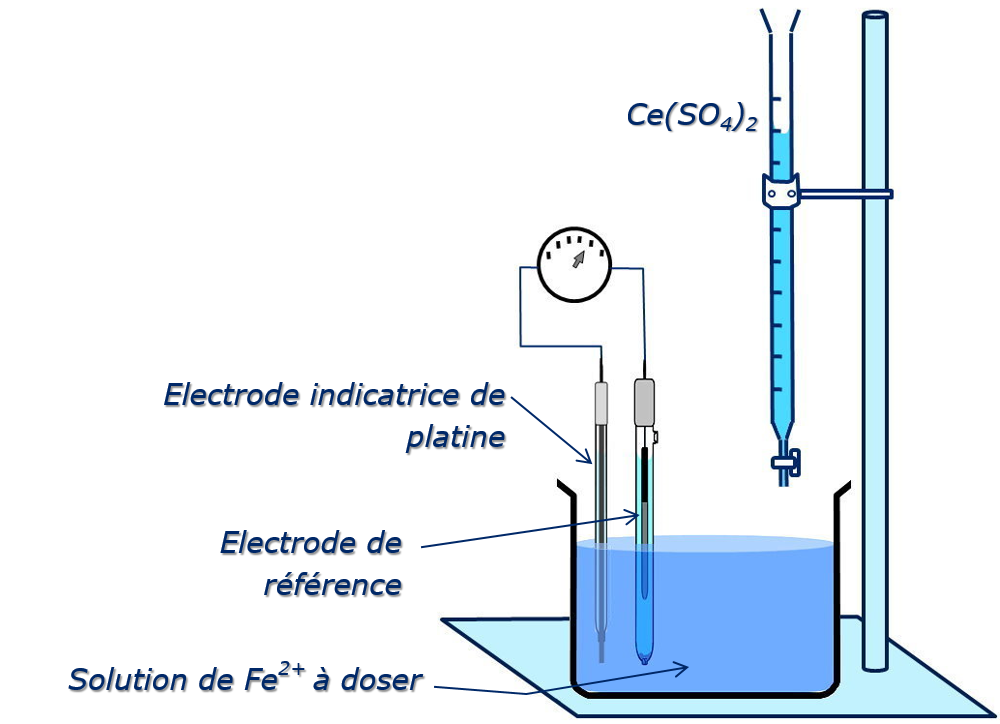
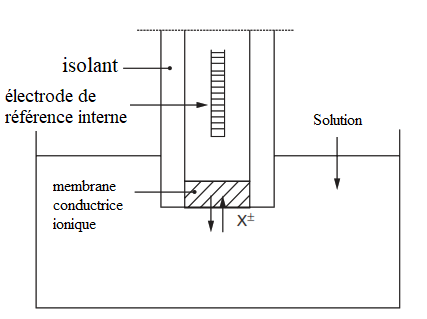
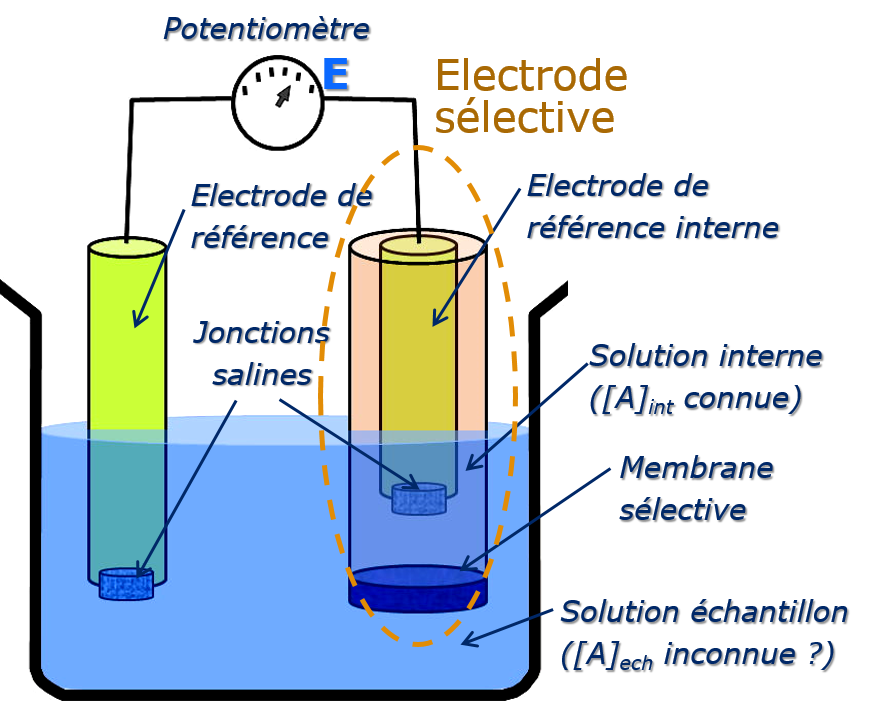
Électrodes à membrane sélective
Les électrodes à membrane sélective ou électrodes sélectives ont un principe de fonctionnement particulier qui a permis d’étendre l’utilisation des méthodes potentiométriques à un très grand nombre d’analytes (ions ou molécules).
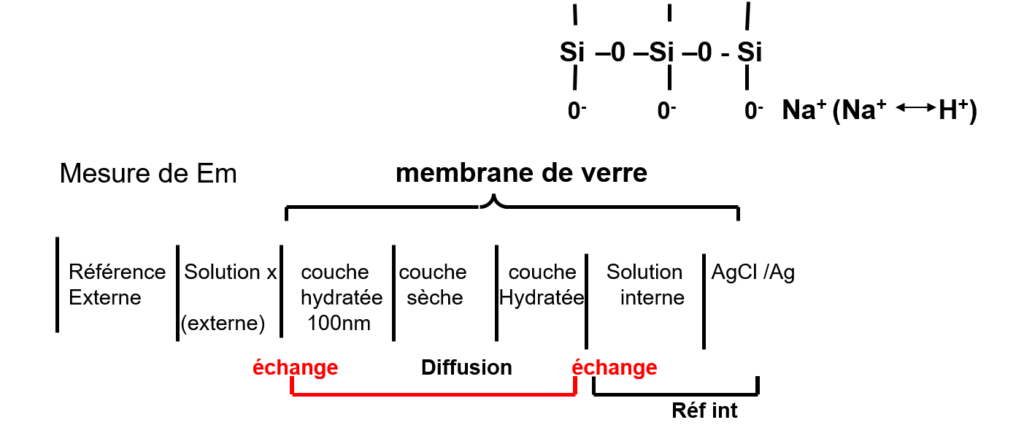
Le développement de cette classe a commencé par la découverte en 1906 qu’une fine membrane de verre développe un potentiel dit potentiel de membrane quand ses deux faces sont en contact avec des solutions où la concentration des ions H+ est différente. Par la suite, ont été développées des membranes ayant une sélectivité pour d’autres ions. Le potentiel développé par ces membrane étant sensible à la différence de concentration d’un analyte particulier entre leur face externe en contact avec la solution de l’échantillon et leur face interne en contact avec une solution de concentration connue.
\begin{align}
E &= E_{Ref int} – E_{Ref} + E_{JL} + E_{membrane} \\
E membrane&=E_{asym} + \dfrac{RT}{zF}\cdot \log \dfrac{[A]_{ech}}{[A]_{int}}
\end{align}
Z : charge de l’analyte
Easym : potentiel lorsque [A]ech = [A]int (idéalement = 0)
\begin{align}
E= K+\dfrac{0,059}{z}\log[A]_{ech}
\end{align}
Il y a plusieurs types d’électrodes sélectives selon la nature de la membrane:
- Électrodes à membrane à conduction ionique
- Membrane solide
- Membrane liquide
- Électrodes à membrane de diffusion gazeuse
- Électrodes à enzymes
Électrodes à membrane solide
Parmi ces électrodes, on classe généralement les électrodes de verre et les électrodes à membranes cristallines.
Électrode de verre (électrode de pH)
Celles-ci sont constituées d’une membrane de verre spécial, conducteur d’ions monovalents (H+ ou ions alcalins) séparant une solution interne d’activité constante, dans laquelle plonge une électrode de référence de potentiel, de la solution à analyser. Les premières électrodes de verre ont été conçues pour mesurer l’activité des ions H+.
![]()
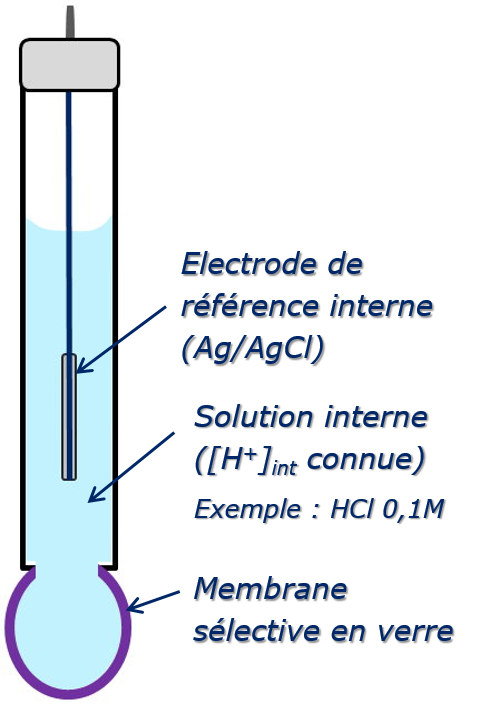
\begin{align} H^+ + Membrane-Na^+ \rightleftharpoons Na^+ + Membrane-H^+ \end{align}
Le phénomène se produit de part et d’autre de la membrane. La différence de (H+) des solutions en contact avec les deux faces donne naissance au potentiel de membrane.
La mesure du pH d’une solution nécessite un calibrage préalable du pH-mètre.
On utilise des solutions étalons de pH déterminé.
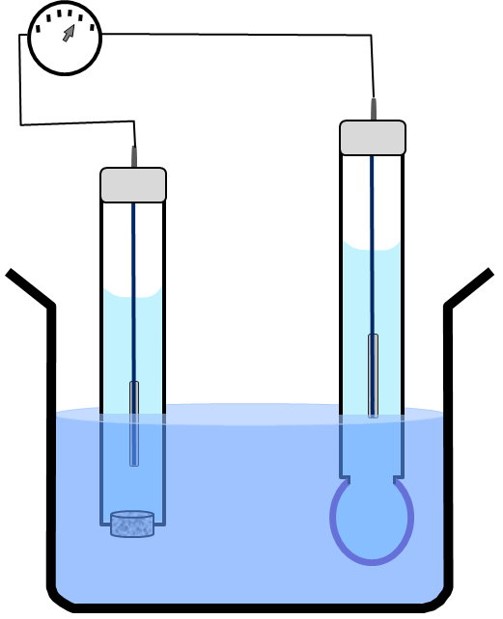
L’utilisation d’une électrode en verre simple nécessite une électrode de référence externe.
| °C | tartrate saturée KHC4H4O7 | 0.05 M citrate KH2C6H5O7 | 0.05 M phthlate KHC8H4O4 | 0.025M KH2PO4 0.025M NaHPO4 | 0.0087M KH2PO4 0.0304M Na2HPO4 | 0.01M Na4B4O7 | 0.025M NaHCO3 0.025M Na2CO3 |
| 25 | 3.557 | 3.776 | 4.008 | 6.865 | 7.413 | 9.180 | 10.012 |
| 30 | 3.552 | 3.766 | 4.015 | 6.854 | 7.400 | 9.139 | 9.966 |
| 35 | 3.549 | 3.759 | 4.024 | 6.844 | 7.389 | 9.012 | 9.925 |
| 40 | 3.547 | 3.753 | 4.035 | 6.838 | 7.380 | 9.068 | 9.889 |
Électrode de verre combinée (schéma)
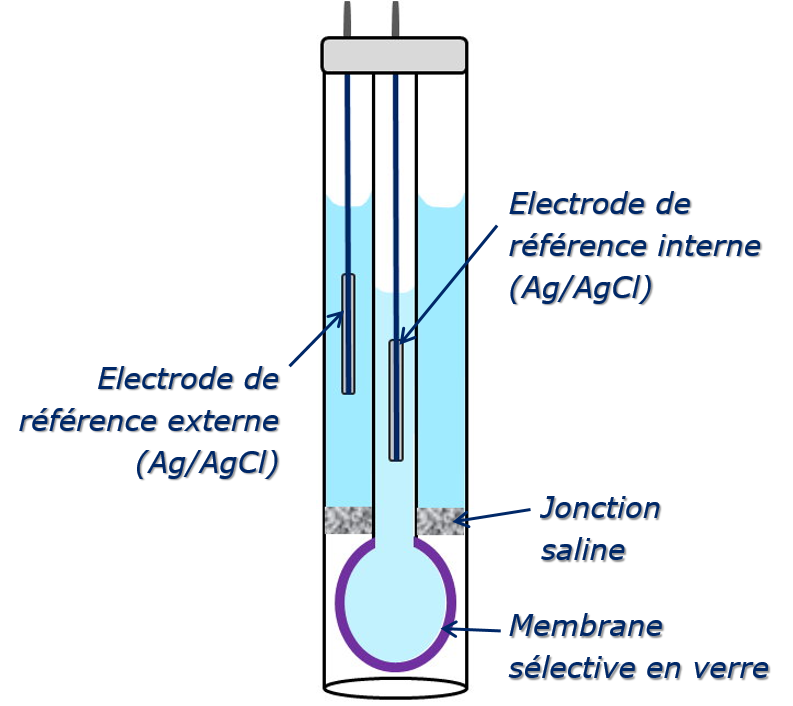
L’électrode combinée de pH rassemble dans le même corps une électrode en verre et une électrode de référence externe.
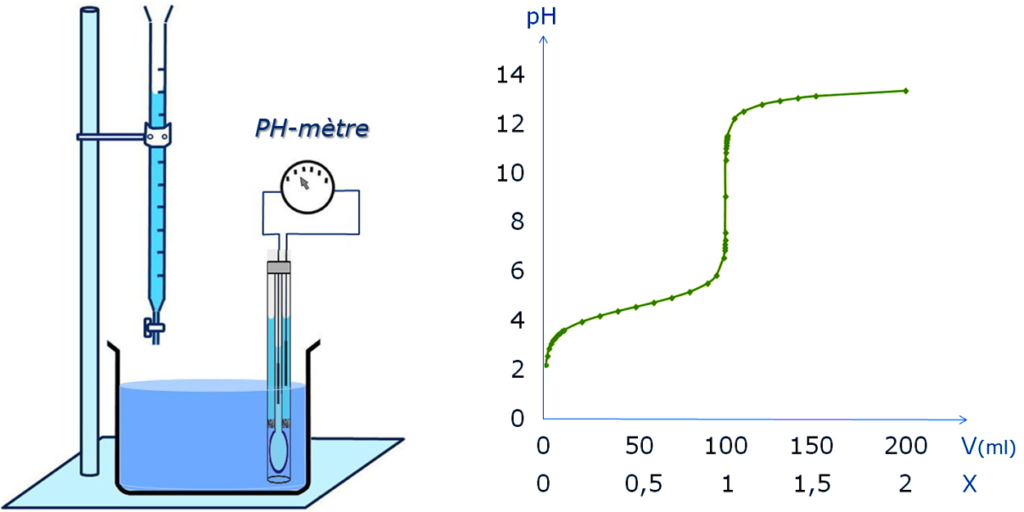
L’électrode de verre est conçu pour déterminer le pH des solutions, mais aussi le suivi de la variation du pH au cours d’un titrage par neutralisation acide-base et détermination du point d’équivalence.
D’autres membranes de verre ont été développées et sont utilisée dans la fabrication d’électrodes sélectives à d’autres ions.
En modifiant la composition du verre, la membrane peut devenir préférentiellement sensible à un autre cation, Na+ par exemple, mais elle restera légèrement sensible à l’ion H+. Dans les mesures, il est alors nécessaire de tenir compte de la sélectivité de la membrane vis-à-vis de l’ion à déterminer.
| Analyte | Composition |
| Na+ | 11 % Na2O, 18% Al2O3, 71%SiO2 |
| Li+ | 15 % Li2O, 25% Al2O3, 60% SiO2 |
| K+ | 27 % Na2O, 5% Al2O3, 68% SiO2 |
Électrode à membrane cristalline :
Elles peuvent être constituées de trois manières :
- Soit à partir d’un monocristal ou d’une association par pression et/ou frittage de petits cristaux de même nature (membrane de LaF3 ou Ag2S)
- Soit à partir d’une association par pression et/ou frittage de petits cristaux de nature différente (membrane de AgCl + Ag2S ou CdS + Ag2S)
L’exemple le plus connu de ces membranes est celui du trifluorure de lanthane (LaF3) dopé avec un sel d’europium (EuF2) ce qui permet aux atomes de fluor (F–) de se déplacer dans le réseau cristallin. Ce matériau, à l’état de monocristal, est utilisé comme membrane pour l’électrode fluorure.
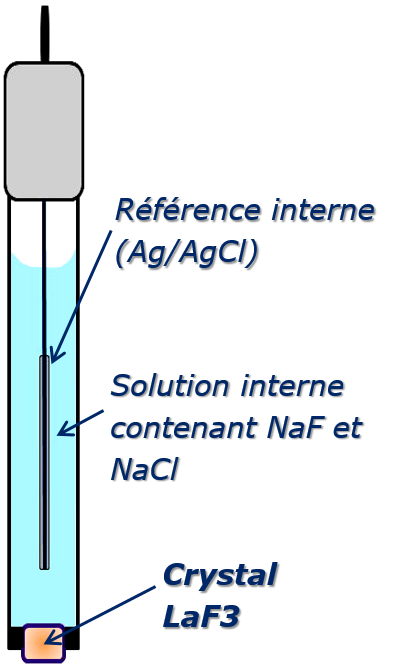
Électrode très sélective, mais elle présente une interférence avec OH–.
D’autres électrodes à membranes cristallines solides sont fabriquées à base de sels d’argents, (essentiellement Ag2S) .
| Analyte | Composition de la membrane |
| Ag+ | Ag2S |
| Cd2+ | CdS/Ag2S |
| Cu2+ | CuS/Ag2S |
| Pb2+ | PbS/Ag2S |
| Br– | AgBr/Ag2S |
| I– | AgI/Ag2S |
| SCN– | AgSCN/Ag2S |
Électrodes à membrane liquide :
À côté des électrodes de verre ont été développées toute une variété d’électrodes à membrane échangeuse d’ions, indicatrices aussi bien de cations que d’anions.
La membrane liquide est constituée d’un échangeur d’ion organique dissous dans un solvant non miscible à l’eau. L’ion échangeable de la membrane se met à l’équilibre avec la solution de référence interne (dans laquelle plonge une électrode de référence de potentiel) et avec la solution externe contenant l’ion à mesurer, de concentration inconnue. L’activité de l’ion dans la solution interne étant constante, seul le potentiel qui se développe à l’autre interface contribue à l’apparition du potentiel de membrane.
À cause d’un temps de réponse relativement lent, d’une dérive de la réponse au cours du temps (modification de la composition de la membrane liquide), et de considérations technologiques (caractère peu pratique de ces électrodes lors du remplacement de la membrane), elles sont désormais supplantées par des électrodes à membrane échangeuse d’ions solide. Ces dernières comprennent un sel organique de l’ion auquel la membrane doit être sensible, lequel est immobilisé dans une mince pellicule de polymère (PVC par exemple).
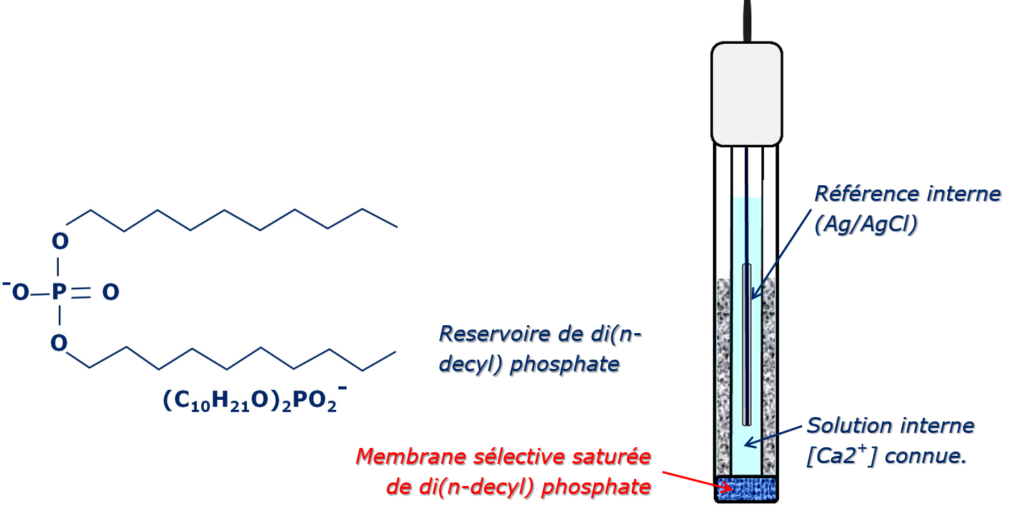
Il existe deux grands types de membranes solides échangeuse d’ions. Le premier correspond à l’immobilisation d’un polymère organique à groupements ioniques échangeables (cationique ou anionique), dissous dans un solvant hydrophobe. C’est le cas par exemple de l’électrode à membrane indicatrice du calcium ( » complexe » calcium-bis (di-n-décylphosphate) dissous dans le (di-n-octylphénylphosphonate) . Que la membrane soit échangeuse de cations ou d’anions, ce sont des interactions de nature électrostatique qui concourent à l’établissement du potentiel de membrane.
Électrode sélective au Ca2+:
Pour l’ion calcium, par exemple, on utilise un diester de l’acide phosphonique (RO)2P(O)O– (ou di(n-decyl) phosphate). De chaque côté de la paroi on est en présence d’équilibres de concentration du type :
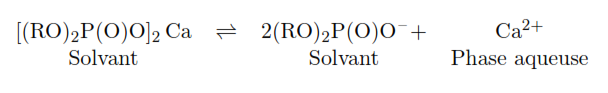
Électrode à gaz
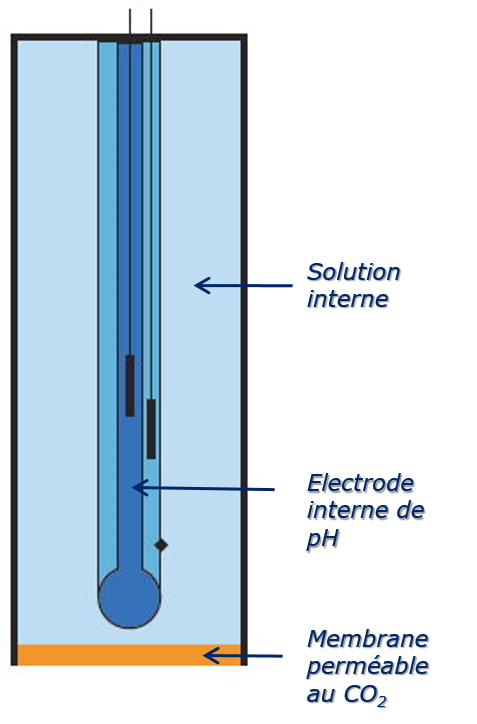
Elles correspondent à une cellule électrochimique miniaturisée, comportant une électrode de référence de potentiel couplée à une électrode à membrane. Cette dernière est choisie de manière à répondre aux variations de concentration du gaz à mesurer (CO2, NOx, NH3, etc.) par l’intermédiaire d’un paramètre (pH essentiellement), relié à la pression partielle du gaz dans la solution.
Une fine membrane perméable uniquement au gaz en question sépare la solution de l’échantillon d’une solution interne contenant une électrode sélective à un composé produit par la réaction du gaz avec la solution interne.
Électrode de CO2: électrode de severinghaus
Le dioxyde de carbone (CO2) traverse la membrane puis donne la réaction :
\begin{align}CO_2 + 2 H_2O \rightleftharpoons H_2CO_3 \rightleftharpoons HCO_3^- + H^+\end{align}
![]() Diminution du pH détectée par l’électrode de pH interne.
Diminution du pH détectée par l’électrode de pH interne.
\begin{align} a_{H_3O^+}=K\cdot \dfrac{a_{CO_2}}{a_{HCO_3^-}} \Rightarrow E_{cell}= K^{\prime}+0,05916 \log a_{CO_2} \end{align}
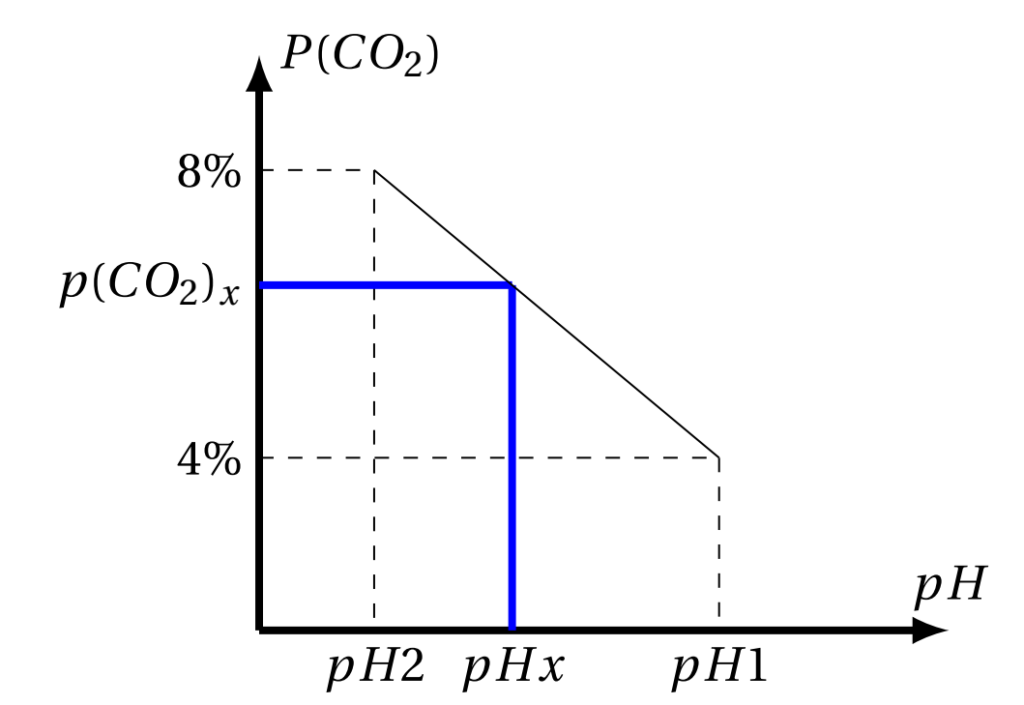
La concentration de H+ est en rapport avec La concentration de H2CO3 , donc avec la pression partielle de CO2 (P(CO2)).
La figure ci-dessous montre la détermination graphique de la P(CO2) inconnue d’une solution grâce à une courbe d’étalonnage.
| H+ | en rapport avec | H2CO3 | donc avec P (CO2) (Pression partielle de CO2)
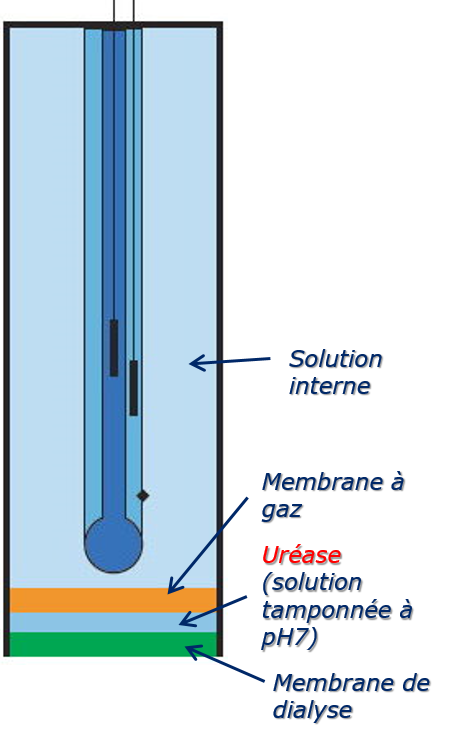
Exemple d’électrodes à gaz :

Électrodes à membrane enzymatique :
Une enzyme est fixée (immobilisée) à la surface de l’électrode en contact avec la solution échantillon. La réaction de l’enzyme avec une biomolécule précise (son substrat) produit un composé gazeux qui peut traverser la membrane sélective (qui lui est perméable), réagir avec la solution interne. L’un des produits de cette réaction est détecté par l’électrode sélective interne.
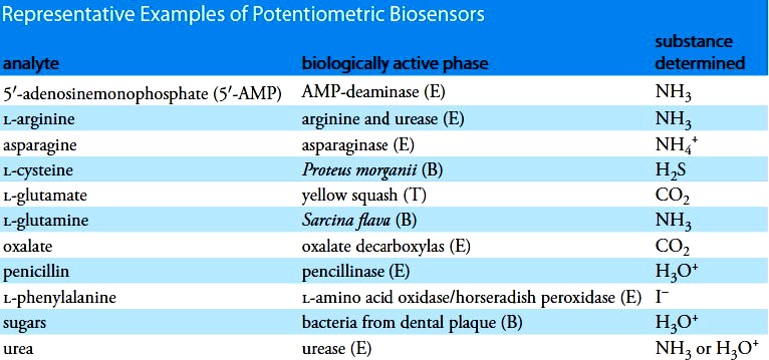
D’autres variantes de ces électrodes, appelées aussi Bio-senseurs ont été développés à base d’antibiotiques, récepteurs d’hormones ou particules d’origine bactérienne.
Électrode à urée :
\begin{align} (NH_4)_2CO + 2H_2O& \rightleftharpoons 2NH_4^+ + HCO_3^-\\ NH_4^+ + H_2O &\rightleftharpoons NH_3 + H_3O^+\\ NH_3 + H_2O &\rightleftharpoons NH_4^+ + OH^-\\ \Rightarrow E{cell}&= K^{\prime}+0,05916 \log a_{\text{urée}} \end{align}
| Analyte | Phase biologique active | Substance déterminée |
| 5′-AMP | AMP-desaminase (E) | NH3 |
| Asparagine | Asparaginase (E) | NH4+ |
| Oxalate | Oxalate décarboxylase (E) | CO2 |
| Penicilline | Pénicillinase (E) | H3O+ |
| Urée | Urease (E) | NH3 ou H3O+ |
Électrode à glucose oxydase.
\begin{align} \text{Glucose } + O_2 + H_2O \rightarrow \text{acide gluconique } + H_2O_2 \end{align}
Détection :
- Potentiométrique : Mesure des ions H+
- Ampérométrie ; coulométrie
Considérations pratiques :
- Définir le domaine de linéarité de la réponse,
- Vérifier que la réponse est nernstienne (± 0,058 ions monovalents ; ± 0,029 ions bivalents),
- Temps de réponse (dépend de: l’analyte, C, état de l’électrode, interférences),
- Définir les interférences et le Coefficient potentiométrique de sélectivité.
Techniques potentiométriques
Potentiométrie directe
Principe
La mesure est directe de la concentration d’une espèce en solution avec une électrode à membrane sélective à l’espèce.
La mesure se fait après élaboration d’un étalonnage.
Mesure du pH : le système est constitué de pH mètre avec une électrode combinée (électrode de verre et électrode de référence le plus souvent Ag/AgCl)
\begin{align} E = E^{\prime} – 0,059 pH \end{align}
Dans les conditions habituelles d’utilisation d’une électrode de verre (concentration des solutés au plus égale à 1mol.L-1) l’erreur acide est nulle; elle ne se manifeste que pour les solutions acides très concentrées.
L’erreur alcaline peut être beaucoup plus importante. Elle est liée aux propriétés échangeuses d’ions de la membrane de verre et au fait qu’en milieu basique (pH > 10), l’activité des cations alcalins apportés par les bases (Na+, K+ principalement) devient considérablement plus grande que celle des ions K+. Il y a alors compétition entre les ions H+ et les cations alcalins pour pénétrer dans la membrane.
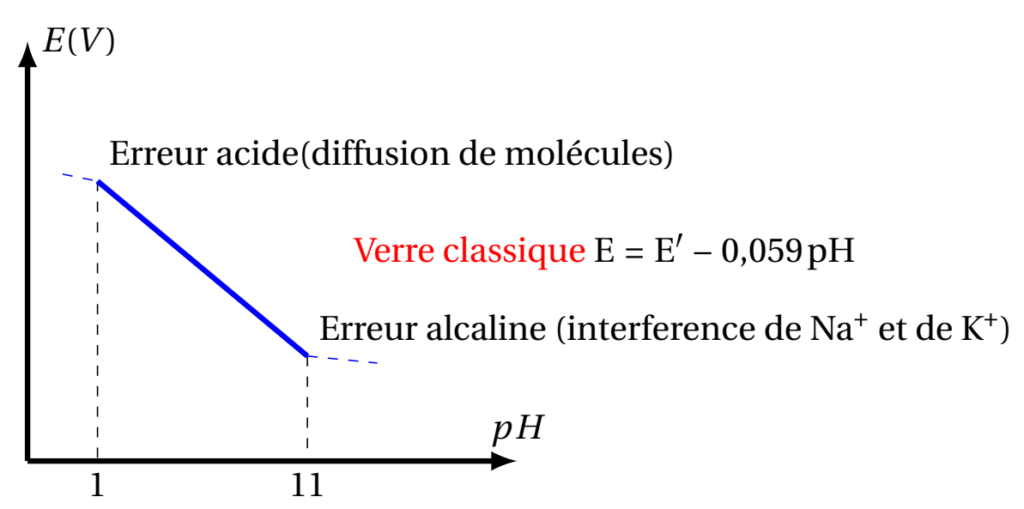
C’est pour remédier à cet inconvénient qu’ont été introduits les électrodes de verres de silicate de Lithium qui présente une bonne sélectivité, avec un domaine de pH : 1 – 14.
Mesure pratique du pH :
- Étalonnage : deux points à t° = constante à l’aide de tampons étalons primaire ou secondaire, par exemple: Tampons phosphates (pH : 7,392 – 6,839)
- Mesure du pH sanguin : Électrode de verre thermostatée à 37°C
Vérification des caractéristiques d’une électrode sélective avant la mesure :
- Définir le domaine de linéarité de la réponse à l’aide d’étalons,
- Vérifier que la réponse est nernstienne (± 0,058 ions monovalents ; ± 0,029 ions bivalents)
- Temps de réponse (dépend de : l’analyte, concentration, état de l’électrode, interférences),
- Définir les interférences et le coefficient potentiométrique de sélectivité.
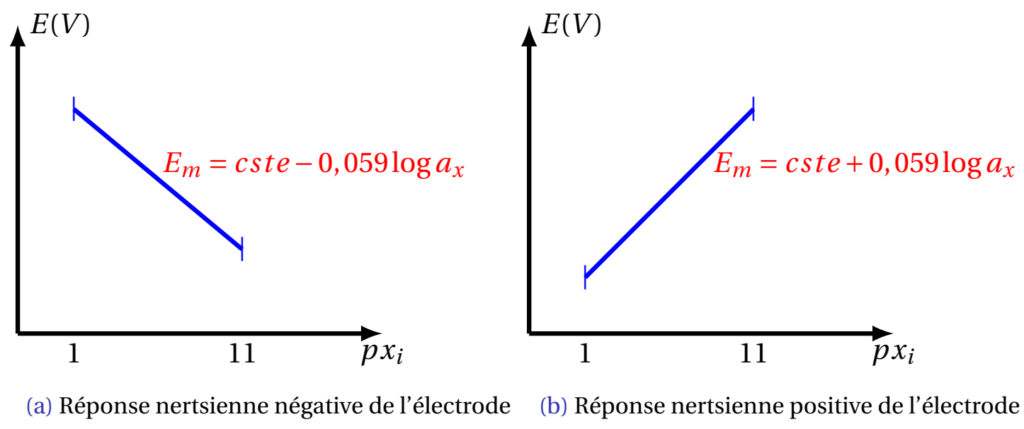
Interférences
En pratique : pas de sélectivité exclusive pour un ion, pour l’électrode de verre (H+) par exemple les ions interférents : Na+, K+, Li+
La connaissance des valeurs des constantes de sélectivité potentiométrique permet d’évaluer l’importance de l’interférence d’un ion X+ dont l’activité est connue.
Coefficient potentiométrique de sélectivité:
![]() avec X+ : interférent
avec X+ : interférent
Relation de Nikolsky-Eisenman (X: ion et Y: interférent)
\begin{align} E = constante + \dfrac{RT}{Fz_x} \log \left(a_{x} + \sum K^{POT}{x,y} . a_y^{\left(\dfrac{z{x}} z_{y}}\right)}\right) \end{align}
Exemple : X+ = Na+
\begin{align} E = constante + \dfrac{RT}{F} \log \left(a_{H^+} + K^{POT}_{H^+,Na^+} . a{Na^+}\right)\end{align}
 : électrode sélective à Na+ sans interférence de H+
: électrode sélective à Na+ sans interférence de H+ : pas d’interférence
: pas d’interférence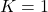 : électrode répond 50 % à H+ et 50 % à Na+
: électrode répond 50 % à H+ et 50 % à Na+
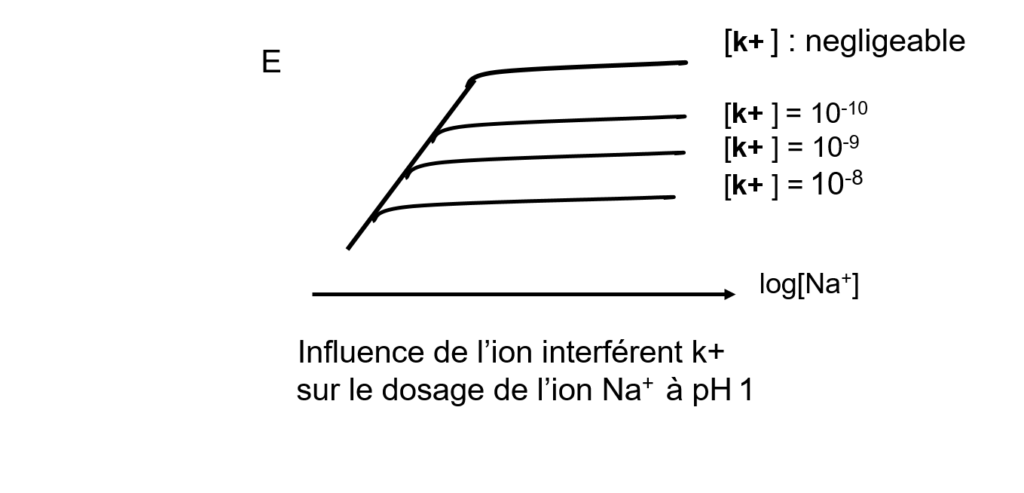
Ex d’interférence sur électrode de verre:
Composition Sélectivité
Na2O 11% K POT Na+/ K+ : 2800 à pH1
Al203 18% K POT Na+/ K+ : 300 à pH7
SiO2 71%
Potentiométrie indirecte
Dosages potentiométriques sont effectuées au cours des réactions de :
- précipitation
- oxydo –réduction
- acide – base
- complexation
Principe : dosage volumétrique
- Graphique
- Titrateur automatique.
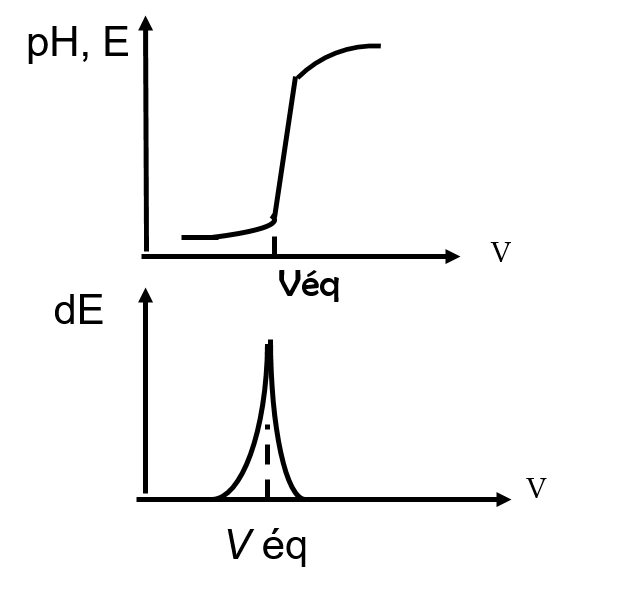
Exemples de dosage
Les réactions de précipitation
Dosage des halogénures X– par Ag+
Électrode indicatrice : électrode d’argent
Électrode de référence : électrode au Hg2SO4 ; E = 0.682V
Réaction chimique de dosage :
(3) 
Réaction électrochimique :
(4) ![]()
Principe :
\begin{align}
E &= f ( c) : \text{ courbes de polarisation }\\
i& = f ( E )
\end{align}
| Cl– | Ag+ | AgCl | ||
| t0 | x=0 | C0 | 0 | 0 |
| t1 | x<1 | C0.(1 X) | …… | C0 . X |
| t’1 | x=0,99 | C0.(1 X) | …… | C0 . X |
| t2 | x=1 | …… | …… | C0 |
| t’2 | x=1,01 | …… | 0,01.C | C0 |
| t3 | x>1 | …… | C0.(X 1) | C0 |

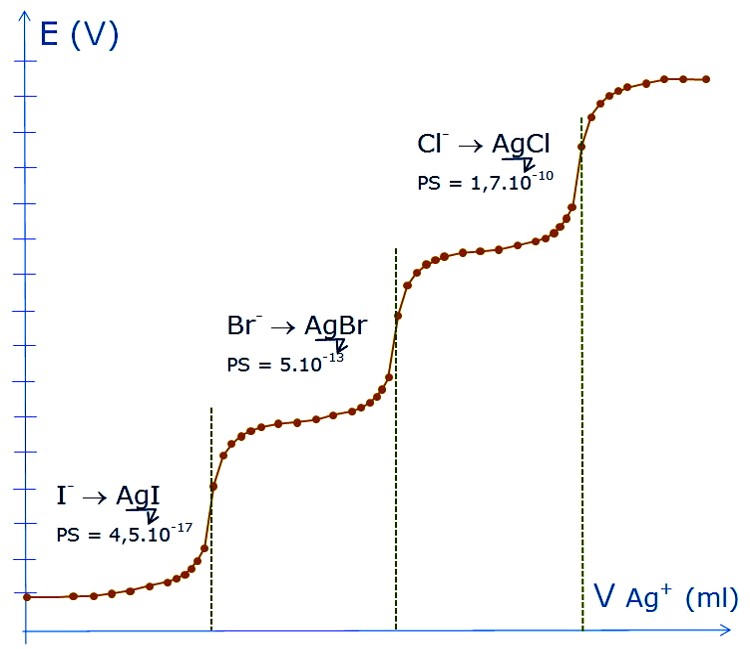
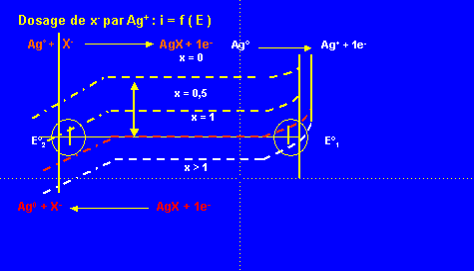
Dosage d’un mélange I- , Br- ,Cl- par Ag+
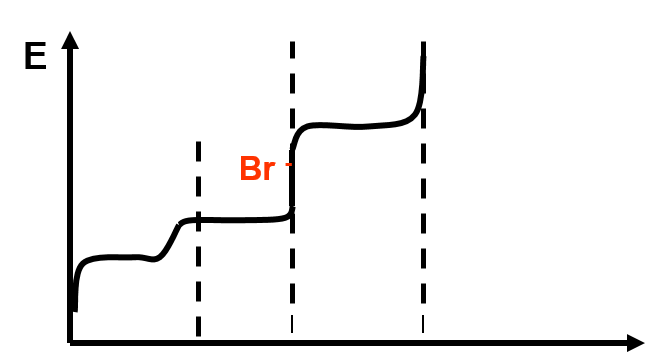
\begin{align} Ps_{AgI} &= 10^{-16} mol^2 \cdot l^{-2} \\Ps_{AgBr} &= 10^{-12} mol^2 \cdot l^{-2} \\Ps_{AgCl} &= 10^{-10} mol^2 \cdot l^{-2} \end{align}
Valeurs des potentiels:
Dosage de Cl– par Ag+
Avant équivalence :
\begin{align} E&= E^0_{Ag^+/Ag} + 0.06 \cdot \log [Ag^+] \quad Ps = [Ag^+] [Cl^-]\\ E &= E^0_{AgCl/Ag} – 0.06 \cdot \log [Cl^-] \end{align}
Après le point équivalent :
\begin{align} E = E^0 {Ag^+/Ag} + 0,06 \cdot \log [Ag^+] \end{align}
Dosage de Cl– ou de Ag+
Au point équivalent :
\begin{align} [Ag^+] = [Cl^-] = \sqrt{Ps} \quad \quad E = E^0_{Ag^+/Ag} + 0,06 \cdot \log \sqrt{Ps} \end{align}
Application
Potentiométrie directe
Utilisation des électrodes à M.S.
- Secteur biomédical:
- pH
- équilibre acide-base
- ionogramme
- glucose, urée, acide urique
- Secteur agroalimentaire:
- Composition minérale
Potentiométrie indirecte
- Plus précise
- Électrode sélective = électrode indirecte
- Application au dosage au cours des Réactions par :
- protométrie : E de verre, ECS
- précipitation : Ag, ESMS
- oxydo – réduction, PT, ECS
- complexation : Hg, ECS
- Réactions d’oxydo – réduction
Avantages :
Automatisation : titrateur automatique
Dosage ionométrique simultané
Miniaturisation : électrode combinée : dosage in site
Réactions d’oxydo- réduction: titrage redox ; Ex : Fe2+ par Ce4+
Électrode indicatrice : fil de platine
Électrode de référence : ECS
Réactions :
\begin{align} Fe^{2+} &\rightleftharpoons Fe^{3+} + 1e^- \\ Ce^{4+} + 1e^- &\rightleftharpoons Ce^{3+} \\ Ce^{4+} + Fe^{2+} &\rightleftharpoons Ce^{3+} + Fe^{3+} \end{align}
\begin{align} E^0_{Ce^{4+}/Ce^{3+} } = 1,44 V / \text{ENH} \qquad E^0_{Fe^{3+}/Fe^{2+}} = 0,77V / \text{ENH} \end{align}
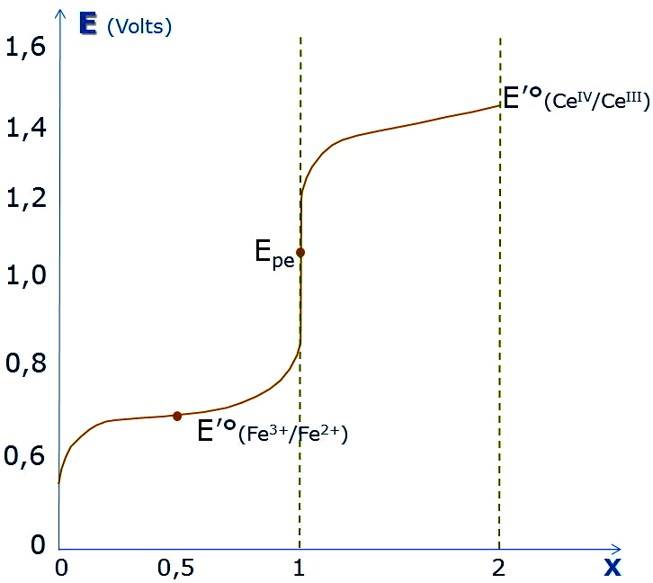
Dosage de Fe2+ par Ce4+ : i = f (E)
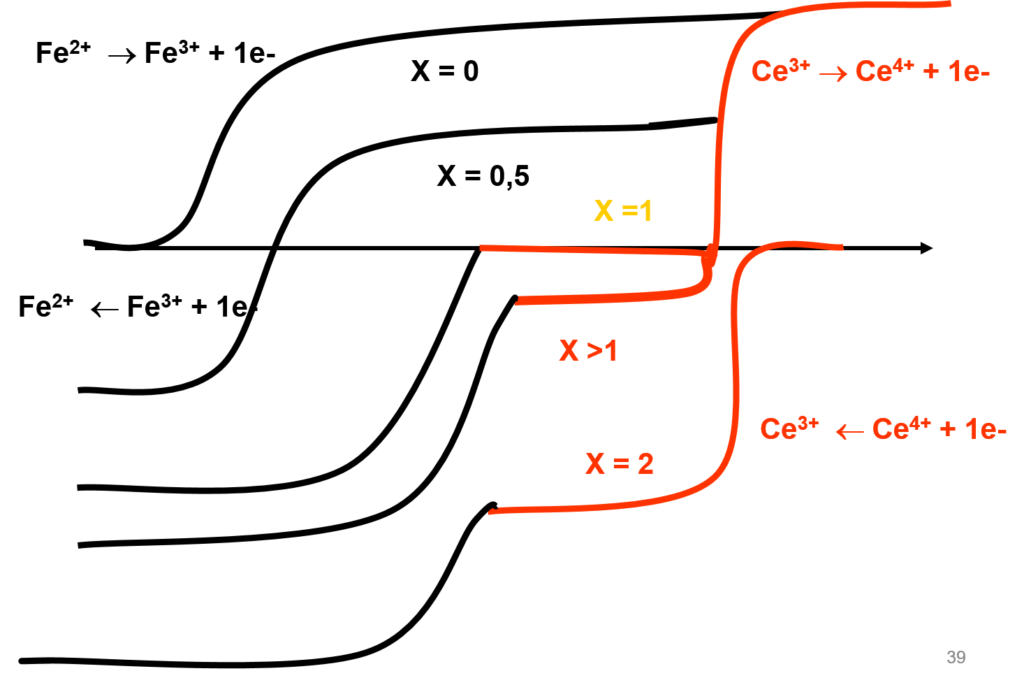
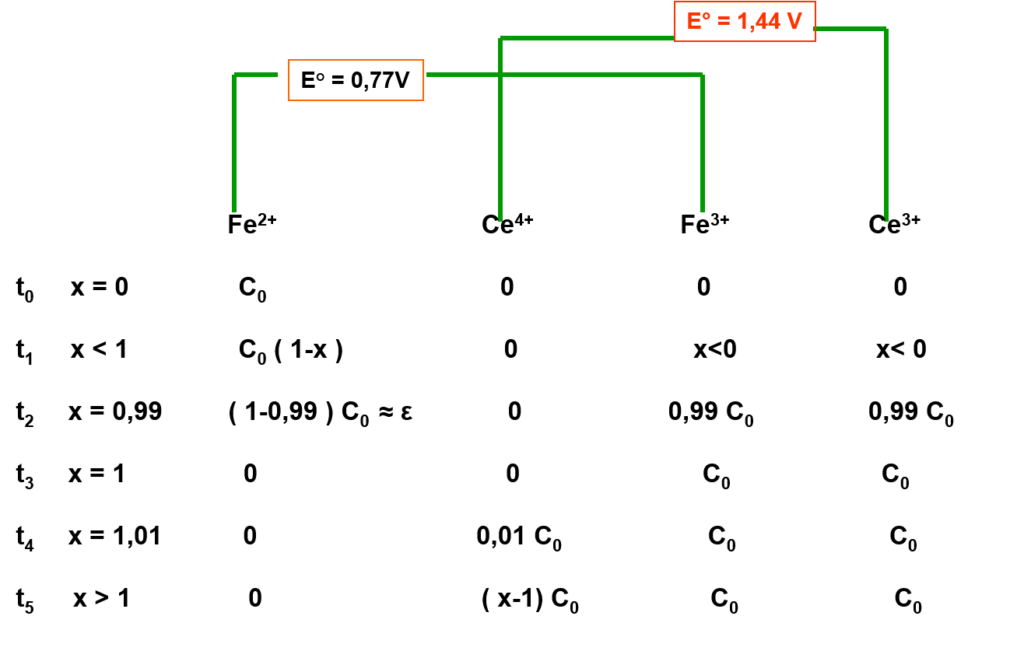
Détermination du point équivalent
à i = 0 , i = -i ![]() , i = +i
, i = +i ![]()
Fe2+ par Ce4+
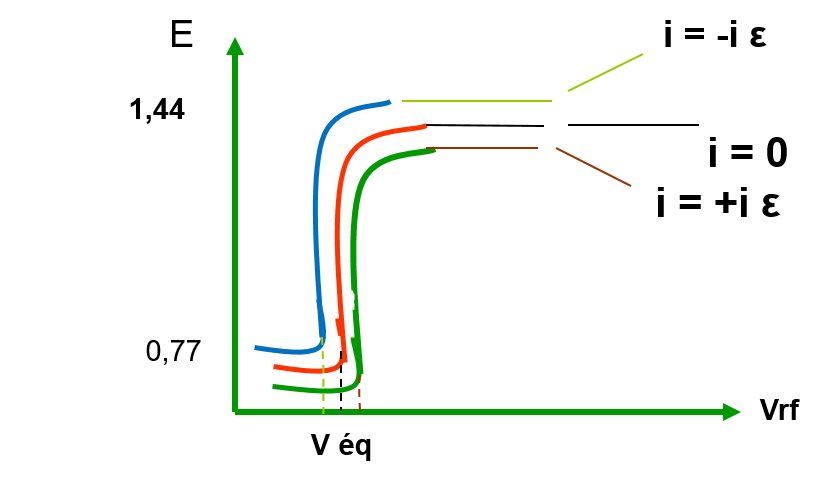
Toujours un excès infime pour stabiliser le potentiel ![]()
Share this content:
Table des matières