Gravimétrie
Cette technique regroupe toutes les méthodes basées sur une détermination pondérale.
La substance pesée peut provenir:
- d’une réaction de précipitation,
- ou constituer un résidu d’une volatilisation ou d’une extraction.
La gravimétrie est l’une des méthodes d’analyse quantitative les plus anciennes (utilisée bien avant les méthodes titrimétriques).
Dans les méthodes gravimétriques par précipitation, la substance à doser est convertie quantitativement en un composé insoluble.
Ces méthodes par précipitation sont à distinguer de :
- L’électrogravimétrie: L’élément ou le composé à doser est déposé sur une électrode par électrolyse.
- La gravimétrie par volatilisation: Mesure de la perte de masse consécutive au dégagement d’un composé.
Protocole du dosage gravimétrique
- Prise d’essai de l’échantillon avec mise en solution éventuelle
- Précipitation sous la forme choisie
- Séparation et lavage du précipite
- Séchage et pesée
Conditions de précipitation (isolement)
Le composé à analyser doit être précipité sous une forme aussi insoluble que possible (Ps très faible) , de façon à réduire les pertes au minimum. Les paramètres qui conditionnent ce choix sont d’ordre physique et chimique.
Choix du composé (précipité)
- Il est guidé par la valeur du Ps. On considère que la réaction de précipitation est quantitative lorsque le Ps est inférieur à
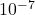 . ( En fait le Ps ne permet de comparaison que si les coefficients sont les mêmes. A titre d’exemple, on ne peut pas comparer
. ( En fait le Ps ne permet de comparaison que si les coefficients sont les mêmes. A titre d’exemple, on ne peut pas comparer 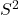 et
et 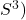 .
. - Intervient également le coefficient de transformation; plus le PM du composé est élevé, plus faible est l’erreur sur la pesée. De là résulte l’intérêt des réactifs organiques de précipitation tel que la diméthylglyoxime, l’hydroxy-8 quinoléine (oxime).
- Ps permet le calcul des concentrations des espèces existantes en solution, à condition d’utiliser les Ps effectifs et de tenir compte de l’environnement ionique.
Conditions physiques
Étude de la solubilité (S) en fonction de T°C et la taille des grains
- Si peu saturée, peu de germes, (gros grains);
- Si sursaturée, beaucoup de germes (petits cristaux). Donc travailler en milieu homogène. Le réactif de précipitation peut être préparé in situ; degré de sursaturation bas, avec peu de germes formés. On obtient de gros cristaux .
- T°C : Pour une même concentration, une solution est plus facilement sursaturée à froid qu’à chaud.
- A froid
 grains très fins et quelquefois des colloïdes.(Solution sursaturée)
grains très fins et quelquefois des colloïdes.(Solution sursaturée) - A chaud
 favorable à la formation de grosses particules.(Solution peu saturée)
favorable à la formation de grosses particules.(Solution peu saturée)
Conditions chimiques
- Effets d’ions commun: Solubilité (S) diminue
- Effets d’ions étrangers:
- Si les ions ne sont pas spécifiques, S d’un composé augmente quand la concentration en sels augmente. Exemple : la solubilité du
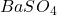 est deux fois plus élevée dans une solution des chlorures que dans l’eau, d’où la condition de ne pas introduire trop de substances étrangères.
est deux fois plus élevée dans une solution des chlorures que dans l’eau, d’où la condition de ne pas introduire trop de substances étrangères. - Si les ions sont spécifiques, prendre en compte l’influence du pH , de l’hydrolyse, la compétition et le recul d’ionisation.
- Si les ions ne sont pas spécifiques, S d’un composé augmente quand la concentration en sels augmente. Exemple : la solubilité du
- Conditions de pureté : Celles-ci visent à éliminer les impuretés ou à les diminuer : Co-précipitation, adsorption, inclusions…
Conditions de pesée
Le produit obtenu par précipitation peut ne pas être le plus propre à la pesée ; en outre, il peut-être, dans les meilleures conditions, au moins souillé par l’eau ou le solvant utilisé; donc avant de le peser, il va falloir éliminer celui ci.
Les solvants très volatils (l’éther ou l’acétone, posent peu de problèmes)
Le seul solvant très gênant est l’eau.
Souvent, on est obligé :
- d’opérer sous vide (ou sous pression réduite)
- de chauffer
- d’ajouter un desséchant et même les trois.
NB: s’assurer que le composé n’est pas détruit ! en examinant les courbes de pyrolyse.
Applications
Méthodes directes
Opérer par pesée, après simple chauffage ou calcination.
Exemple :
- Oxalate et sulfate de fer.
- Iodate et chlorure de potassium.
Méthodes par extraction
Effectuer une pesée après extraction et évaporation.
Il faut diminuer l’ionisation pour que le composé recherché soit extrait dans le solvant organique, par exemple:
- Détermination des Principes Actifs (PA) des drogues végétales.
- Dosage du benzoate de lithium par extraction par l’éther en milieu chlorhydrique. Après évaporation on pèse l’acide benzoïque.

Méthodes par précipitation
Éléments minéraux
- Cations → sulfure
- Halogène → sel d’argent
- S;
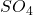 →
→ 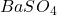
- P;
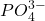 →
→ 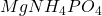 →
→ 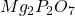 (gravimétrie)
(gravimétrie) -
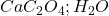 →
→ 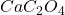 →
→ 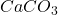 →
→ 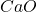 (thermogravimétrie)
(thermogravimétrie)
cations: un certain nombre de réactifs organiques permettent de précipiter plus spécifiquement les cations. On peut citer comme exemple le dimethylglyoxine ou 8-hydroxyquinoleine (ou oxine). Il faudra deux
ou trois molécules de ces coordinats bidentés pour un cation suivant que sa coordinance est 4 ou 6.
Molécules organiques
On réalise le blocage de fonctions qui solubilisent le corps étudié et en même temps on alourdit la molécule.
Exemple :
- Aldéhydes ou cétones: On forme les oxines ou les hydrazones. Par exemple, on prépare la 2-4 dinitrophénylhydrazone du camphre, ou la phénylhydrazone de l’aldéhyde benzoïque.
- Alcools phénols: On forme les dérivés acétylés
- Composés basiques, alcaloïdes, vitamines: On forme des dérivés silico-tungstiques.
Share this content:
Table des matières

