Généralités sur l’électrochimie
Théories simplifiées de l’électrolyse
- Échange des e-
- Déplacement des ions
- Prévision des réactions
 E équilibre
E équilibre  E équilibre
E équilibre
Potentiel d’équilibre (E. rédox, E. électrode)
Soit une solution d’un système Redox
\begin{align}Ox + e- \rightarrow Red\\
Red – e- \rightarrow Ox \end{align}
un fil conducteur en platine (Pt)
L’échange d’e- entre Pt et Ox ou Red il s’établit un équilibre.
La composition de la solution est constante au voisinage de l’électrode.
L’électrode de Pt prend un potentiel E d’équilibre (Nernst):
![]()
Ex. Fe3+/Fe2+ ; CuSO4/Cu
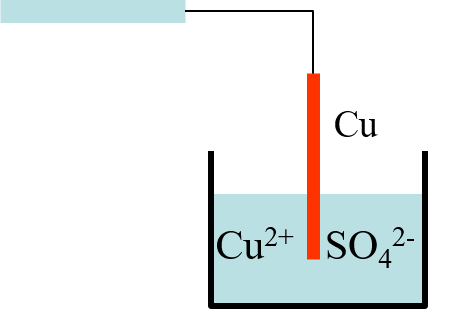
Potentiel de l’électrode: Cu2+/Cu:
- Réduction: e- pris au Cu qui se charge (+). La solution perd Cu2+ se charge (-). Le Cu attire les SO42-. Apparition d’une double couche et donc un champ électrique s’opposant à la réduction.
- Oxydation: le cuivre metal Cu libère des e-; le métal se charge (-) ; la solution gagne des Cu2+ se charge (+) d’où un champ électrique.
Dans les deux cas, il apparaît un potentiel E entre le Métal et la Solution:
E = VM-VS (différence de potentiel interfaciale)
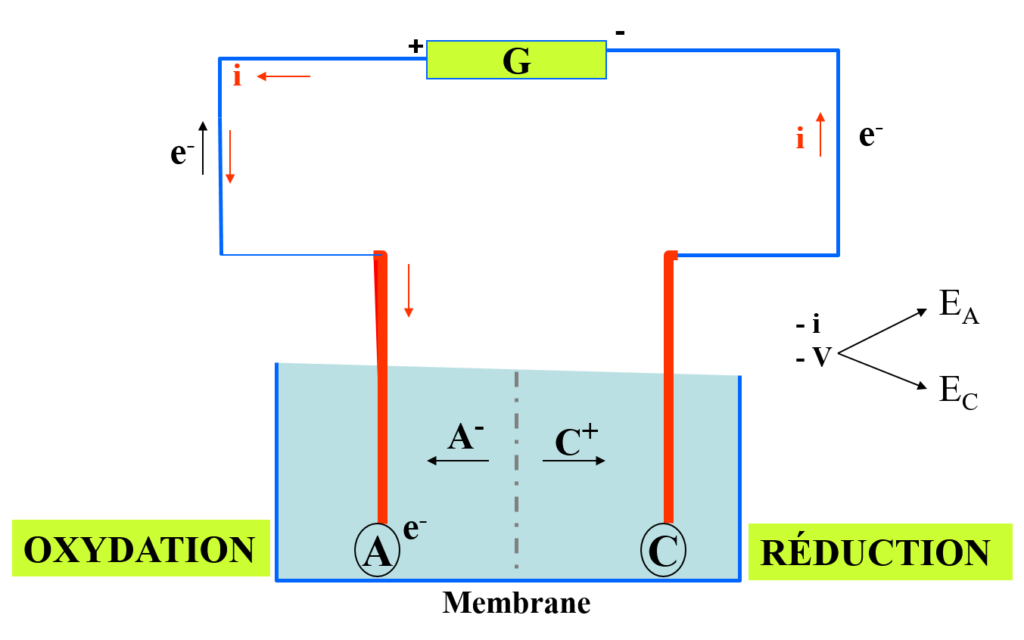
Pile électrochimique (2 demi-réactions ):
2 électrodes plongeant dans 2 solutions de M1 (n1+) et M2 (n2+) séparées et reliées par un pont salin ou membrane:
\begin{align} E_1 = V_{M1}-V_{S1} \text{ et } E_2 = V_{M2}-V_{S2}: \end{align}
Le pont impose l’égalité VS1 = VS2
La différence de potentiel (ddp) observée est : E = VM1-VM2 = Ei= E1– E2 (Voltmètre)
- Équimolaire
 rien
rien - Ei > E
 Oxydation
Oxydation - Ei < E
 Réduction
Réduction
Principe de l’électrolyse
https://media.pearsoncmg.com/bc/bc_0media_chem/chem_sim/html5/Electro/Electro.php
Ex. CuCl2
\begin{align} \text{A :}\qquad & Cl- \rightleftharpoons \dfrac{1}{2}Cl_2 + e^- &\Rightarrow E_{Cl} = E^0 + ….\\ \text{ C :} \qquad &\dfrac{1}{2}Cu^{2+} + e^- \rightleftharpoons \dfrac{1}{2}Cu &\Rightarrow E_{Cu} = E^0 + …. \end{align}
Conditions de l’électrolyse:
![]()
(1) ![]()
NB: l’échange d’e- peut être lent.
Potentiel imposé à G : ![]()
Prévisions des réactions
Règles :
- Substances oxydables ANODE
- Substances réductibles CATHODE. (Remarque: la charge n’intervient pas)
- Substance à E (-) élevé s’oxyde en premier
- Substance à E (+) élevé est réduite en premier
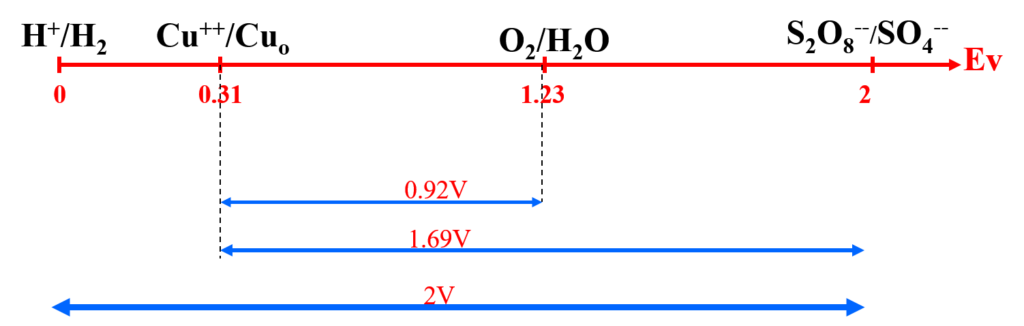
Ex. CuSO4 (0.1M) en milieu H2SO4 (M/2)
Oxydations possibles:
Réductions possibles:
\begin{align} Cu^{2+} +2 e^- &\rightleftharpoons Cuo \qquad E = 0.34 + \dfrac{0.06}{2} log [Cu^{2+}] = 0.31V \\ 2H^+ +2 e^- &\rightleftharpoons H_2 \qquad E = E^0 = 0 \end{align}
- Chercher la ddp à appliquer (Conditions d’électrolyse)
- Appliquer les règles
- C1 : réduction Cu2+
- A1 :oxydation H2O
- C1 : réduction Cu2+
- A1 : oxydation H2O
électrolyse a lieu si :
EA1– EC1 > 0.92 ; EA> 1.23 et EC < 0.31
Remarques:
- Cette condition est nécessaire mais non suffisante car l’échange des e- peut être infiniment lent. C’est ce que nous examinons dans la seconde partie
- les substances qui disparaissent (par électrolyse) :
dissoutes: ions ; molécules ou M de l’électrode M+
solvant: H2O \textrightarrow O2 \\ \textrightarrow H2
Les substances qui apparaissent : gaz ou précipité, si M0, il recouvre l’électrode.
Quand une substance participe aux réactions d’électrolyse sa concentration diminue.
Ex. Ag+ (E0 = 0,8 V) est réduit avant Cu2+.
Question: Quand démarre la réduction de Cu2+?
Réponse: Eéq (Ag+) devient < Eéq (Cu2+)
Les substances qui se forment à l’anode par oxydation peuvent passer en solution et être réduites à la cathode. => membrane
Théories I = f(E)
Première hypothèse : vitesse d’échangés des électrons finie (i ≡ nombre d’électrons)
Oxydant ou Réducteur seul
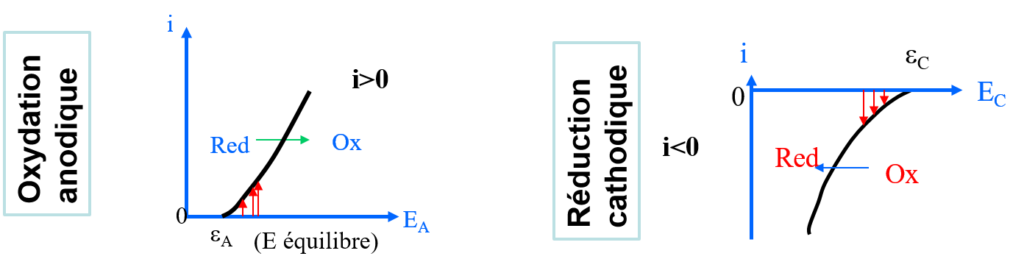
Oxydant et réducteur d’un même couple
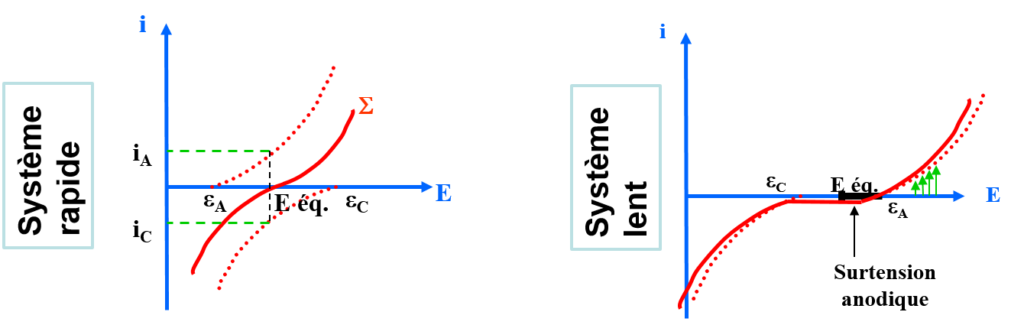
Prévision des réactions
I = f (E) connues
Ex : solution acide Fe3+, S2O82- ; (Électrode graphite)
Oxydation : H2O/O2 , E° = 1,33 V + sur-tention = 2,83 V
Réduction :
gggggg
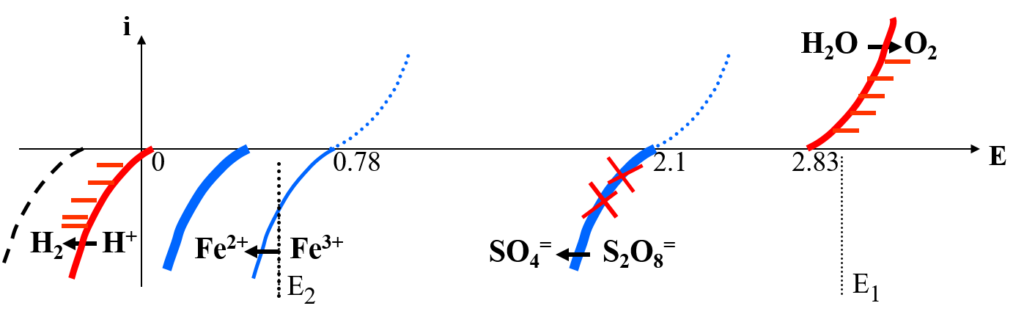
SV : → mur (domaine)
(X) : non électroactive
Appliquer E1E2 : Fe3+ à Fe2+ ?
Théorie tenant compte des phénomènes de transport
Généralités
Vitesse de transport en solution finie
On distingue 3 modes de transport de matière en solution:
- Migration im: déplacement des ions sous l’effet du champ électrique dans un gradient de potentiel électrique.
- Diffusion id : déplacement de matière des milieux les plus concentrés vers les moins concentrés. La diffusion est le déplacement sous l’effet d’un gradient de potentiel chimique.
- Convection ic: les déplacements dus à des phénomènes autres que la migration et le diffusion sont rangés sous le nom de convection. ils peuvent être dus à un gradient de température, de pression… L’agitation mécanique de la solution est le plus important.
Migration
- Influence de E sur les ions
- n e- échangés à la surface de l’électrode
- n charges passent dans la solution
Diffusion
Variation de la concentration au voisinage d’électrode à gradient de concentration
Convection
Autres causes de déplacement ; T°, vibration, densité, agitation…
iéle = im + id + ic
Courant de diffusion
Nernst : hypothèse : diffusion limitée à une couche d’épaisseur ![]() autour de l’électrode
autour de l’électrode
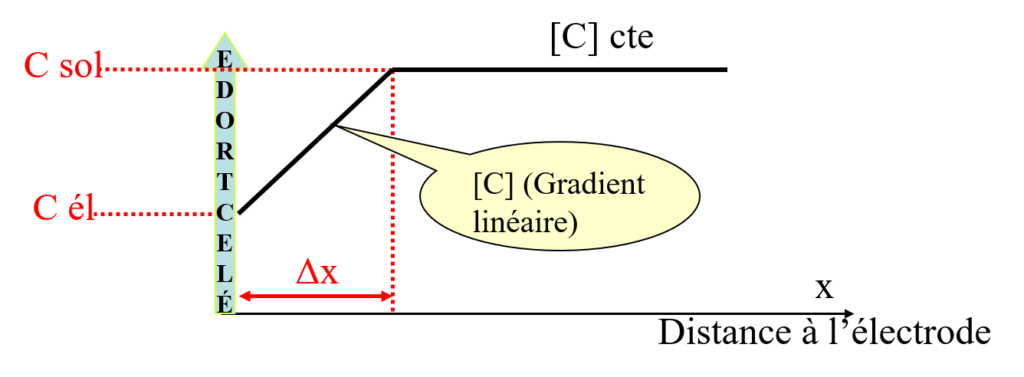
Loi de Fick : vitesse de transport par diffusion ![]() au gradient linéaire de concentration.
au gradient linéaire de concentration.
!!!!!!dxdt=SD⋅(Cs−Cel)Δx \\
Allures des courbes
\begin{align} id &= K Fe^{2+} [Fe^{2+}s – Fe^{2+}{el}]\\
Fe^{2+}_{el}& \longrightarrow 0 \qquad \qquad i_d \longrightarrow i_l\\
i_l &= K Fe^{2+} [Fe^{2+}]_s \text{ mesure sur pallier}
\end{align}
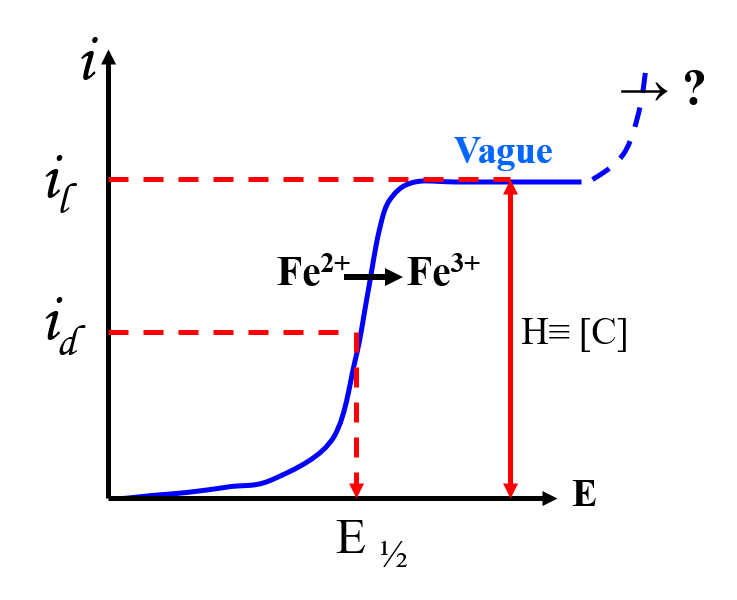
Domaine d’électroactivité
Étude :
- Tracer le mur
- Choix du solvant, d’électrode
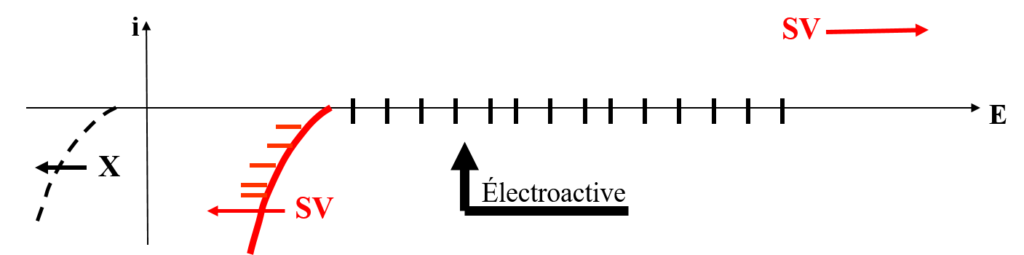
Exemple. CH3CN augmente le domaine/ H2O
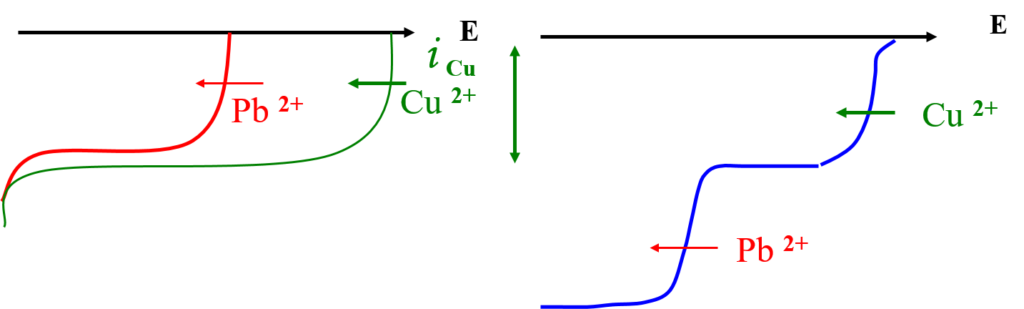
Additivité des (i )
Techniques d’analyses électrochimiques
Trois composantes :
C : Concentration
E : Potentiel
I : Intensité
On fixe un paramètre et on suit la variation de l’un en fonction de l’autre.
- C fixe: i = f (E): Polarographie; Voltamètrie
- E fixe: i = f (C): Ampérométrie; Coulométrie (Coductimétrie)
- I fixe: E = f (C): Potentiométrie; Ionométrie
Share this content:
Table des matières


