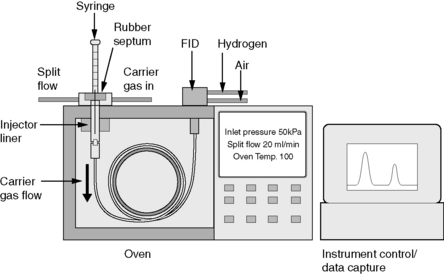
Chromatographie en Phase Gazeuse (CPG) :
Introduction
La chromatographie en phase gazeuse (CPG) est une technique d’analyse puissante et largement utilisée en pharmacie. Elle permet la séparation, l’identification et la quantification des composés volatils et thermiquement stables présents dans un échantillon. Ce cours vous fournira une compréhension approfondie des principes fondamentaux de la CPG, de son instrumentation, de ses applications spécifiques en pharmacie et des bonnes pratiques pour son utilisation.
I. Principes Fondamentaux
1.1. Définition et Principe de Séparation
- Définition : La CPG est une technique de séparation basée sur la distribution différentielle des composés d’un échantillon entre une phase mobile gazeuse et une phase stationnaire liquide ou solide.
- Principe de Séparation :
- L’échantillon est vaporisé et entraîné par un gaz vecteur (phase mobile).
- Les composés se distribuent entre la phase gazeuse et la phase stationnaire en fonction de leurs propriétés physico-chimiques (volatilité, polarité, interactions avec la phase stationnaire).
- Les composés ayant une plus forte affinité pour la phase mobile éluent plus rapidement que ceux ayant une plus forte affinité pour la phase stationnaire.
1.2. Paramètres Clés de la Séparation
- Volatilité : Aptitude d’un composé à passer en phase gazeuse. Les composés très volatils éluent en premier.
- Polarité : Influence des interactions intermoléculaires (liaisons hydrogène, forces de Van der Waals) sur la rétention des composés.
- Température : Contrôle la volatilité des composés et influence la séparation.
- Phase Stationnaire : La nature de la phase stationnaire (polarité, épaisseur) est cruciale pour la sélectivité de la séparation.
- Gaz Vecteur : Détermine la vitesse de migration des composés et peut influencer la résolution.
1.3. Vocabulaire Essentiel
- Gaz Vecteur (Phase Mobile) : Gaz inerte (hélium, azote, hydrogène) qui transporte l’échantillon à travers la colonne.
- Phase Stationnaire : Liquide (greffé sur un support solide) ou solide qui interagit avec les composés de l’échantillon.
- Colonne : Tube contenant la phase stationnaire où a lieu la séparation.
- Chromatogramme : Représentation graphique de la réponse du détecteur en fonction du temps.
- Temps de Rétention (tR) : Temps nécessaire à un composé pour éluer de la colonne.
- Aire du Pic : Proportionnelle à la quantité du composé injecté.
- Résolution (Rs) : Mesure de la séparation de deux pics adjacents. Rs > 1.5 indique une séparation complète.
- Facteur de Capacité (k’) : Indique le temps qu’un analyte passe dans la phase stationnaire comparé au temps passé dans la phase mobile.
Parfait ! Approfondissons les parties II (Instrumentation de la CPG) et III (Applications en Pharmacie) pour un cours plus complet.
II. Instrumentation de la CPG (Version Détaillée)
2.1. Source d’Alimentation en Gaz Vecteur
- Rôle : Fournir un flux constant et pur de gaz vecteur à travers le système. Le gaz vecteur est essentiel pour transporter l’échantillon vaporisé à travers la colonne et vers le détecteur.
- Gaz Vecteurs Couramment Utilisés :
- Hélium (He) : Le plus utilisé en raison de son inertie chimique, de sa conductivité thermique élevée (idéal pour les détecteurs TCD) et de sa faible viscosité (permet des débits élevés). Toutefois, il est plus cher et moins durable que d’autres options.
- Hydrogène (H2) : Offre une efficacité de séparation similaire à l’hélium et permet des analyses plus rapides. Il est souvent utilisé avec le FID (car il participe à la réaction de détection). Cependant, il est inflammable et nécessite des précautions de sécurité accrues.
- Azote (N2) : Moins cher et plus sûr que l’hélium et l’hydrogène. Il est souvent utilisé avec les détecteurs TCD. Cependant, il offre une efficacité de séparation inférieure.
- Argon (Ar) : Utilisé principalement avec les détecteurs à ionisation (par exemple, le détecteur à capture d’électrons, ECD).
- Composants de la Source :
- Bouteilles de Gaz : Stockent le gaz vecteur sous haute pression. Elles doivent être manipulées avec précaution et fixées correctement.
- Régulateurs de Pression : Réduisent la pression du gaz de la bouteille à une pression de travail stable pour le chromatographe.
- Purificateurs de Gaz : Éliminent les impuretés (eau, oxygène, hydrocarbures) du gaz vecteur pour protéger la colonne et améliorer la sensibilité du détecteur.
- Débitmètres : Mesurent le débit du gaz vecteur. Ils peuvent être électroniques (plus précis) ou mécaniques (rotamètres). Un débit précis et stable est crucial pour la reproductibilité des analyses.
- Importance de la Pureté du Gaz Vecteur : Les impuretés dans le gaz vecteur peuvent entraîner :
- Bruit de fond élevé.
- Réduction de la sensibilité du détecteur.
- Dégradation de la phase stationnaire de la colonne.
- Résultats d’analyse inexacts.
2.2. Injecteur
- Rôle : Introduire l’échantillon dans le flux du gaz vecteur de manière rapide et reproductible. La vaporisation de l’échantillon doit être complète et homogène.
- Types d’Injecteurs :
- Injection Directe (Direct Injection) :
- L’échantillon est directement injecté dans la colonne.
- Convient aux échantillons concentrés et aux analyses quantitatives où la précision est primordiale.
- Peut entraîner une surcharge de la colonne si l’échantillon est trop concentré.
- Split/Splitless :
- Split : Une partie de l’échantillon vaporisé est évacuée (split), tandis que le reste est introduit dans la colonne. Utilisé pour les échantillons concentrés pour éviter la surcharge de la colonne. Le ratio de split est un paramètre important à optimiser.
- Splitless : Tout l’échantillon vaporisé est introduit dans la colonne. Utilisé pour les échantillons dilués pour augmenter la sensibilité. Nécessite un « trap » (piège) pour retenir les solvants.
- Injection « On-Column » :
- L’échantillon est injecté directement dans la colonne à basse température, puis la température est augmentée progressivement.
- Idéal pour les composés thermolabiles qui pourraient se décomposer à haute température dans l’injecteur.
- Injection Directe (Direct Injection) :
- Paramètres Importants :
- Température de l’Injecteur : Doit être suffisamment élevée pour vaporiser complètement l’échantillon, mais pas trop élevée pour éviter la décomposition des composés.
- Volume d’Injection : Volume d’échantillon injecté dans le système. Il doit être optimisé pour éviter la surcharge de la colonne et assurer une bonne résolution.
- Type de Seringue : Utiliser une seringue appropriée pour le volume d’injection et le solvant utilisé.
2.3. Colonne
- Rôle : Séparer les différents composés de l’échantillon en fonction de leurs propriétés physico-chimiques.
- Types de Colonnes :
- Colonnes Remplies :
- Tube en verre ou en métal rempli d’un support solide inerte (diatomées, silice) recouvert d’une phase stationnaire liquide.
- Moins efficaces que les colonnes capillaires, mais plus robustes et moins chères.
- Utilisées pour les analyses simples et les applications générales.
- Colonnes Capillaires :
- Tube en silice fondue recouvert d’une couche de polyimide (pour la flexibilité). La phase stationnaire est directement greffée sur la paroi interne (colonnes wall-coated open tubular – WCOT) ou sur un support solide (colonnes support-coated open tubular – SCOT).
- Offrent une meilleure résolution et une plus grande sensibilité que les colonnes remplies.
- Types de phases stationnaires :
- Phases Polaires : Polyéthylène glycol (PEG), utilisées pour la séparation des composés polaires (alcools, acides organiques, amines).
- Phases Apolaires : Polydiméthylsiloxane (PDMS), utilisées pour la séparation des composés apolaires (hydrocarbures, lipides).
- Phases Intermédiaires : Phényldiméthylsiloxane, cyanopropyldiméthylsiloxane.
- Phases Chirales : Utilisées pour la séparation des énantiomères (molécules chirales).
- Colonnes Remplies :
- Paramètres Importants :
- Longueur de la Colonne : Plus la colonne est longue, meilleure est la résolution, mais plus le temps d’analyse est long.
- Diamètre Interne de la Colonne : Les colonnes plus étroites offrent une meilleure résolution, mais nécessitent des débits plus faibles.
- Épaisseur du Film de Phase Stationnaire : Influence la rétention des composés. Un film plus épais augmente la rétention et la capacité de charge de la colonne.
- Polarité de la Phase Stationnaire : Doit être choisie en fonction de la polarité des composés à séparer (« like dissolves like »).
2.4. Four
- Rôle : Maintenir la colonne à une température contrôlée et précise. La température influence la volatilité des composés et leur rétention sur la phase stationnaire.
- Types de Contrôle de la Température :
- Isotherme : La température est maintenue constante pendant toute l’analyse. Convient aux mélanges simples de composés ayant des volatilités similaires.
- Programmation de la Température : La température est augmentée progressivement au cours de l’analyse. Permet de séparer des mélanges complexes de composés ayant des volatilités très différentes.
- Paramètres Importants :
- Température Initiale : Température de départ du programme.
- Taux d’Augmentation de la Température : Vitesse à laquelle la température augmente.
- Température Finale : Température maximale atteinte pendant le programme.
- Temps de Maintien à la Température Finale : Durée pendant laquelle la température est maintenue à la température finale.
2.5. Détecteurs
Rôle : Détecter les composés qui éluent de la colonne et générer un signal proportionnel à leur quantité.
Types de Détecteurs (Développement) :
- FID (Flame Ionization Detector) :
- Principe : Les composés organiques éluent de la colonne et sont brûlés dans une flamme d’hydrogène. Les ions produits sont collectés par une électrode, générant un courant électrique proportionnel à la quantité de carbone.
- Avantages : Sensible, robuste, réponse linéaire pour la plupart des composés organiques.
- Inconvénients : Ne détecte pas l’eau, les gaz rares, les gaz inorganiques et les composés complètement halogénés.
- Applications : Analyse des hydrocarbures, des alcools, des acides organiques, des esters, etc.
- TCD (Thermal Conductivity Detector) :
- Principe : Mesure la différence de conductivité thermique entre le gaz vecteur pur et le gaz vecteur contenant les composés éluent de la colonne.
- Avantages : Universel (détecte presque tous les composés), non destructif.
- Inconvénients : Moins sensible que le FID.
- Applications : Analyse des gaz permanents, de l’eau, des solvants, etc.
- ECD (Electron Capture Detector) :
- Principe : Utilise une source radioactive (nickel-63) pour ioniser le gaz vecteur. Les composés contenant des groupes électronégatifs (halogènes, nitro) capturent les électrons, réduisant le courant.
- Avantages : Très sensible aux composés halogénés, aux pesticides, aux PCB.
- Inconvénients : Ne détecte que les composés électrophiles, nécessite une source radioactive.
- Applications : Analyse des pesticides, des produits pharmaceutiques halogénés, des polluants environnementaux.
- MS (Spectromètre de Masse) :
- Principe : Les composés éluent de la colonne sont ionisés et fragmentés. Les ions sont séparés en fonction de leur rapport masse/charge (m/z) et détectés.
- Avantages : Permet l’identification des composés (spectre de masse unique), très sensible, peut être utilisé en mode SIM (selected ion monitoring) pour augmenter la sensibilité.
- Inconvénients : Plus coûteux et complexe que les autres détecteurs.
- Applications : Identification des composés inconnus, analyse des mélanges complexes, quantification des composés à l’état de traces.
- FID (Flame Ionization Detector) :
2.6. Système d’Acquisition de Données
- Rôle : Enregistrer et traiter les signaux du détecteur.
- Fonctions :
- Acquisition des données : Conversion du signal analogique du détecteur en signal numérique.
- Affichage du chromatogramme : Représentation graphique de la réponse du détecteur en fonction du temps.
- Intégration des pics : Calcul de l’aire des pics pour la quantification.
- Identification des composés : Comparaison des temps de rétention et des spectres de masse (si MS est utilisé) avec des références.
- Génération de rapports : Création de rapports contenant les résultats de l’analyse.
- Logiciels : De nombreux logiciels sont disponibles (Agilent ChemStation, Thermo Scientific Chromeleon, etc.).
III. Applications en Pharmacie (Version Détaillée)
3.1. Contrôle Qualité des Médicaments
- Analyse des Impuretés :
- Objectif : S’assurer que les matières premières et les produits finis respectent les limites d’impuretés spécifiées par les pharmacopées (USP, EP, JP).
- Méthodologie : Utilisation de la CPG pour séparer et quantifier les impuretés. Comparaison des temps de rétention et des spectres de masse (si MS est utilisé) avec des références connues.
- Exemples :
- Recherche de solvants résiduels dans les produits pharmaceutiques.
- Détection des produits de dégradation dans les formulations.
- Analyse des impuretés organiques volatiles dans les excipients.
- Détermination de la Pureté des Principes Actifs :
- Objectif : Vérifier que le principe actif est suffisamment pur pour être utilisé dans les médicaments.
- Méthodologie : Utilisation de la CPG pour séparer et quantifier le principe actif et les impuretés. Calcul du pourcentage de pureté.
- Exemples :
- Analyse de la pureté de l’aspirine.
- Détermination de la pureté du paracétamol.
- Vérification de la pureté des stéroïdes.
- Dosage des Excipients :
- Objectif : S’assurer que les excipients sont présents dans les quantités spécifiées dans la formulation.
- Méthodologie : Utilisation de la CPG pour séparer et quantifier les excipients.
- Exemples :
- Dosage des alcools (éthanol, isopropanol) dans les solutions.
- Analyse des glycols (propylène glycol, polyéthylène glycol) dans les crèmes et les pommades.
- Vérification de la Conformité aux Spécifications des Pharmacopées :
- Objectif : S’assurer que les médicaments respectent les normes de qualité établies par les pharmacopées.
- Méthodologie : Utilisation de la CPG pour effectuer les tests spécifiés dans les pharmacopées (identification, pureté, dosage).
3.2. Analyse des Fluides Biologiques
- Détermination des Concentrations de Médicaments (Pharmacocinétique) :
- Objectif : Mesurer les concentrations de médicaments dans le plasma, l’urine, la salive, etc., pour étudier l’absorption, la distribution, le métabolisme et l’excrétion (ADME) des médicaments.
- Méthodologie :
- Extraction du médicament du fluide biologique (extraction liquide-liquide, SPE).
- Dérivatisation (si nécessaire) pour améliorer la volatilité ou la détectabilité.
- Analyse par CPG avec un détecteur approprié (MS est souvent utilisé pour la sensibilité et la spécificité).
- Utilisation de standards internes pour la quantification.
- Exemples :
- Suivi thérapeutique de la théophylline.
- Détermination des concentrations de cyclosporine dans le sang.
- Analyse des antidépresseurs dans le plasma.
- Recherche de Substances Toxiques ou de Drogues (Toxicologie) :
- Objectif : Détecter et quantifier les substances toxiques ou les drogues dans les fluides biologiques.
- Méthodologie :
- Extraction des substances toxiques ou des drogues du fluide biologique.
- Analyse par CPG-MS pour l’identification et la quantification.
- Utilisation de bibliothèques de spectres de masse pour identifier les composés inconnus.
- Exemples :
- Détection de l’alcool dans le sang.
- Recherche de médicaments illicites dans l’urine.
- Analyse des pesticides dans le plasma.
- Analyse des Métabolites :
- Objectif : Identifier et quantifier les métabolites des médicaments pour étudier le métabolisme et la voie d’élimination.
- Méthodologie : Utilisation de la CPG-MS pour identifier et quantifier les métabolites. Comparaison des spectres de masse avec des références connues ou des bibliothèques de spectres.
3.3. Analyse des Huiles Essentielles et des Produits Naturels
- Identification et Quantification des Composés :
- Objectif : Déterminer la composition chimique des huiles essentielles et des extraits de plantes.
- Méthodologie :
- Analyse directe de l’huile essentielle ou de l’extrait par CPG-MS.
- Identification des composés par comparaison des temps de rétention et des spectres de masse avec des références connues.
- Quantification des composés par rapport à un standard interne.
- Exemples :
- Analyse de l’huile essentielle de lavande.
- Détermination de la composition de l’extrait de romarin.
- Identification des composés actifs dans les plantes médicinales.
- Contrôle de la Qualité et de l’Authenticité :
- Objectif : S’assurer que les huiles essentielles et les extraits de plantes sont authentiques et de bonne qualité.
- Méthodologie :
- Comparaison de la composition chimique avec les normes établies.
- Détection des adultérations (ajout de composés synthétiques ou d’huiles de moindre qualité).
- Exemples :
- Vérification de l’authenticité de l’huile essentielle de tea tree.
- Détection de l’ajout de limonène dans l’huile essentielle de citron.
3.4. Analyse de l’Air et de l’Eau
- Détection des Polluants Organiques Volatils (COV) :
- Objectif : Mesurer les concentrations de COV dans l’air et l’eau.
- Méthodologie :
- Prélèvement d’échantillons d’air ou d’eau.
- Concentration des COV par adsorption sur un support solide (Tenax, Carbotrap).
- Désorption thermique des COV et analyse par CPG-MS.
- Exemples :
- Surveillance de la qualité de l’air dans les laboratoires pharmaceutiques.
- Détection du benzène dans l’eau potable.
- Analyse du toluène dans l’air ambiant.
- Surveillance de la Qualité de l’Air et de l’Eau dans les Environnements Pharmaceutiques :
- Objectif : S’assurer que l’air et l’eau utilisés dans les processus de fabrication pharmaceutiques sont exempts de contaminants.
- Méthodologie : Utilisation de la CPG-MS pour détecter et quantifier les contaminants potentiels (solvants, produits de dégradation, etc.).
IV. Méthodologie et Bonnes Pratiques
4.1. Préparation des Échantillons
- L’échantillon doit être soluble dans un solvant approprié et volatil.
- Techniques d’extraction : extraction liquide-liquide, extraction en phase solide (SPE).
- Dérivatisation : transformation chimique des composés pour augmenter leur volatilité ou leur détectabilité.
4.2. Optimisation des Paramètres de Séparation
- Choix de la colonne (phase stationnaire, longueur, diamètre).
- Programmation de la température du four.
- Débit du gaz vecteur.
- Type d’injecteur et mode d’injection.
- Choix du détecteur.
4.3. Validation des Méthodes
- Sélectivité : capacité à séparer et à détecter le composé d’intérêt en présence d’autres composés.
- Linéarité : relation linéaire entre la concentration et la réponse du détecteur.
- Précision : répétabilité et reproductibilité des résultats.
- Justesse : exactitude des résultats par rapport à une valeur de référence.
- Limites de détection (LOD) et de quantification (LOQ).
4.4. Maintenance et Dépannage
- Entretien régulier du chromatographe.
- Nettoyage de l’injecteur et de la colonne.
- Vérification des fuites de gaz.
- Diagnostic des problèmes courants (pics larges, absence de pics, bruit de fond élevé).
V. Conclusion
La chromatographie en phase gazeuse est un outil essentiel pour l’analyse pharmaceutique. Une bonne compréhension des principes, de l’instrumentation et des applications de la CPG vous permettra d’utiliser cette technique de manière efficace et fiable dans votre future carrière de pharmacien.
VI. Questions de Révision
- Expliquez le principe de séparation en CPG.
- Quels sont les principaux composants d’un chromatographe en phase gazeuse ?
- Décrivez les différents types de détecteurs utilisés en CPG et leurs applications.
- Quelles sont les applications de la CPG en contrôle qualité des médicaments ?
- Comment optimiser les paramètres de séparation en CPG ?
- Pourquoi la validation des méthodes est-elle importante en CPG ?
VII. Ressources Additionnelles
- Livres de chimie analytique
- Articles scientifiques
- Sites web spécialisés (Agilent, Thermo Fisher, etc.)
Share this content:
Table des matières