Spectrométrie de Masse (SM)
Introduction
La spectrométrie de masse (SM) est une technique analytique puissante et polyvalente, essentielle dans de nombreux domaines, notamment en pharmacie. Elle permet d’identifier, de quantifier et de caractériser des molécules en mesurant leur rapport masse/charge (m/z). Ce cours vous fournira une compréhension approfondie des principes fondamentaux de la SM, de son instrumentation, de ses différentes techniques d’ionisation et d’analyse de masse, de ses applications spécifiques en pharmacie, ainsi que de l’interprétation des données.
I. Principes Fondamentaux de la Spectrométrie de Masse
1.1. Définition et Principe de Base
- Définition : La spectrométrie de masse (SM) est une technique analytique qui mesure le rapport masse/charge (m/z) des ions en phase gazeuse.
- Principe de Base :
- Ionisation : Les molécules de l’échantillon sont ionisées pour former des ions en phase gazeuse.
- Analyse de Masse : Les ions sont séparés en fonction de leur rapport m/z dans un analyseur de masse.
- Détection : Les ions séparés sont détectés, et leur abondance relative est mesurée.
- Spectre de Masse : Les résultats sont présentés sous forme d’un spectre de masse, un graphique de l’abondance ionique en fonction du rapport m/z.
1.2. Le Rapport Masse/Charge (m/z)
Définition : Le rapport masse/charge (m/z) est une quantité fondamentale en SM. Il représente la masse (m) d’un ion divisée par sa charge (z).
Unités : Le m/z est une quantité sans dimension, mais on utilise souvent l’unité Dalton par charge (Da/z) ou simplement m/z.
Calcul du m/z :
Pour un ion simplement chargé (z = +1 ou -1), m/z est numériquement égal à la masse molaire de l’ion en Daltons. Pour un ion multiplement chargé (z = ±2, ±3, etc.), le m/z est fractionné de la masse molaire.
où :
mest la masse de l’ion (en Da).zest la charge de l’ion (nombre d’unités de charge élémentaire).
1.3. Ions Moléculaires et Ions Fragments
- Ion Moléculaire (M+• ou [M+H]+ ou [M-H]-) : Ion formé par l’ionisation de la molécule intacte. Il représente souvent la masse moléculaire de l’analyte.
- Ion radical-cation (M+•) : Formé par perte d’un électron (ionisation par impact électronique, IE).
- Ion protoné ([M+H]+) : Formé par addition d’un proton (ionisation chimique, IC ; électrospray, ESI).
- Ion déprotoné ([M-H]-) : Formé par perte d’un proton (électrospray, ESI).
- Ions Fragments : Ions plus petits formés par la fragmentation de l’ion moléculaire. Ils fournissent des informations structurales sur la molécule.
1.4. Spectre de Masse
- Définition : Un spectre de masse est une représentation graphique de l’abondance relative des ions en fonction de leur rapport m/z.
- Axe des abscisses (x) : Rapport masse/charge (m/z).
- Axe des ordonnées (y) : Abondance ionique relative (souvent normalisée au pic de base à 100%).
- Pic Moléculaire : Pic correspondant à l’ion moléculaire (si présent).
- Pic de Base : Pic le plus intense du spectre, auquel on attribue une abondance relative de 100%.
- Ions Fragments : Pics à m/z inférieurs à celui de l’ion moléculaire, résultant de la fragmentation.
- Isotopes : Pics isotopiques (M+1, M+2, etc.) dus à la présence d’isotopes naturels des éléments.
II. Instrumentation en Spectrométrie de Masse
2.1. Schéma Général d’un Spectromètre de Masse
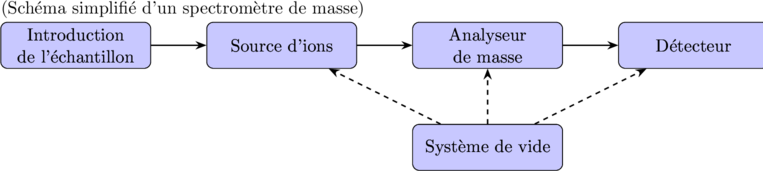
Composants Clés :
- Introduction de l’échantillon (Sample Inlet) :
- Introduit l’échantillon dans le spectromètre de masse.
- Peut être direct (injection liquide, introduction directe) ou couplé à une technique de séparation (chromatographie en phase gazeuse GC-MS, chromatographie liquide LC-MS).
- Source d’ions (Ion Source) :
- Ionise les molécules de l’échantillon.
- Différents types de sources d’ions (voir section III).
- Analyseur de masse (Mass Analyzer) :
- Sépare les ions en fonction de leur rapport m/z.
- Différents types d’analyseurs de masse (voir section IV).
- Détecteur (Detector) :
- Détecte les ions séparés et mesure leur abondance.
- Types de détecteurs : multiplicateur d’électrons, coupe de Faraday.
- Système de vide (Vacuum System) :
- Maintient un vide poussé (
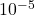 à 10-8 Torr) dans l’analyseur de masse et le détecteur pour minimiser les collisions ion-molécule et permettre le déplacement des ions.
à 10-8 Torr) dans l’analyseur de masse et le détecteur pour minimiser les collisions ion-molécule et permettre le déplacement des ions.
- Maintient un vide poussé (
- Système d’acquisition et de traitement des données (Data System) :
- Acquiert les signaux du détecteur et les convertit en spectres de masse.
- Permet le traitement des données, l’identification des composés et la quantification.
III. Techniques d’Ionisation
Le choix de la technique d’ionisation est crucial et dépend de la nature de l’analyte (volatilité, polarité, masse moléculaire).
3.1. Ionisation par Impact Électronique (IE ou EI)
- Principe : Molécules en phase gazeuse bombardées par un faisceau d’électrons énergétiques (typiquement 70 eV).
- Réaction d’ionisation :
(1) ![]()
- où
Mest la molécule neutre, etM+•est l’ion radical-cation. - Caractéristiques :
- Ionisation « dure » : Forte fragmentation, spectre riche en ions fragments, peu ou pas d’ion moléculaire.
- Adaptée aux composés volatils et thermiquement stables : Hydrocarbures, stéroïdes, alcaloïdes, composés aromatiques.
- Spectres reproductibles et comparables : Utilisée pour la création de bibliothèques spectrales pour l’identification.
- Couplée à la chromatographie en phase gazeuse (GC-MS) : Technique standard en GC-MS.
3.2. Ionisation Chimique (IC ou CI)
- Principe : Ionisation indirecte. Introduction d’un gaz réactif (méthane, isobutane, ammoniac) dans la source d’ions. Le gaz réactif est ionisé par impact électronique, puis les ions réactifs transfèrent une charge aux molécules de l’analyte.
- Ionisation positive (IC+) avec méthane (exemple) :
(2) 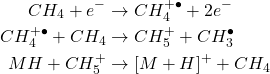
- Formation prédominante d’ions protonés [M+H]+.
- Ionisation négative (IC-) avec méthane (exemple) :
(3) 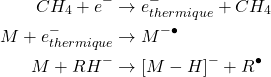
- Formation prédominante d’ions déprotonés [M-H]-.
- Caractéristiques :
- Ionisation « douce » : Moins de fragmentation que l’IE, ion moléculaire (ou [M+H]+, [M-H]-) souvent abondant.
- Adaptée aux composés moins volatils et thermiquement labiles : Sucres, peptides, composés polaires.
- Sensibilité accrue pour certains composés : Notamment en IC-.
- Couplée à la chromatographie en phase gazeuse (GC-MS) : Alternative à l’IE en GC-MS.
3.3. Électrospray (ESI) et Chimioionisation à Pression Atmosphérique (APCI)
- Électrospray (ESI) :
- Principe : Solution de l’analyte pulvérisée à travers une aiguille capillaire sous haute tension. Formation d’un brouillard chargé, évaporation du solvant, réduction de la taille des gouttelettes, répulsion coulombienne, émission d’ions en phase gazeuse.
Solution \rightarrow Brouillard Chargé \rightarrow Évaporation Solvant \rightarrow Gouttelettes Réduites \rightarrow Répulsion Coulombienne \rightarrow Ions Gaz - Caractéristiques :
- Ionisation « très douce » : Très peu de fragmentation, ion moléculaire (souvent multiplement chargé pour les grosses molécules).
- Adaptée aux composés polaires et ioniques, aux biomolécules : Protéines, peptides, acides nucléiques, médicaments polaires.
- Ionisation en phase liquide : Couplée à la chromatographie liquide (LC-MS).
- Ionisation positive ([M+nH]n+) et négative ([M-nH]n-) : Permet d’analyser une large gamme de composés.
- Principe : Solution de l’analyte pulvérisée à travers une aiguille capillaire sous haute tension. Formation d’un brouillard chargé, évaporation du solvant, réduction de la taille des gouttelettes, répulsion coulombienne, émission d’ions en phase gazeuse.
- Chimioionisation à Pression Atmosphérique (APCI) :
- Principe : Échantillon vaporisé et ionisé par une décharge corona à pression atmosphérique, via des réactions ion-molécule similaires à l’IC.
Solution \rightarrow Vaporisation \rightarrow Ionisation par Décharge Corona (Pression Atmosphérique) \rightarrow Ions Gaz - Caractéristiques :
- Ionisation « douce » : Moins de fragmentation que l’IE, mais plus que l’ESI.
- Adaptée aux composés moins polaires et thermiquement stables que l’ESI : Lipides, stéroïdes, médicaments moins polaires.
- Ionisation en phase liquide ou gazeuse : Couplée à la chromatographie liquide (LC-MS) ou introduction directe.
- Ionisation positive ([M+H]+) et négative ([M-H]-) : Permet d’analyser une large gamme de composés.
- Principe : Échantillon vaporisé et ionisé par une décharge corona à pression atmosphérique, via des réactions ion-molécule similaires à l’IC.
3.4. Désorption-Ionisation Laser Assistée par Matrice (MALDI)
- Principe : L’analyte est mélangé à une matrice, déposé sur une plaque, puis irradié par un laser. La matrice absorbe l’énergie laser, provoque la sublimation et l’ionisation de l’analyte.
Analyte + Matrice \rightarrow Dépôt sur Plaque \rightarrow Irradiation Laser \rightarrow Désorption & Ionisation - Caractéristiques :
- Ionisation « douce » : Très peu de fragmentation, principalement des ions simplement chargés ([M+H]+ ou [M+Na]+).
- Adaptée aux grosses biomolécules et polymères : Protéines, peptides, oligosaccharides, polymères synthétiques.
- Tolérance aux sels et aux impuretés : Moins sensible aux contaminants que l’ESI.
- Analyse d’échantillons solides : Pas de couplage direct avec la chromatographie liquide, mais technique complémentaire.
IV. Analyseurs de Masse
Les analyseurs de masse séparent les ions en fonction de leur rapport m/z en utilisant des champs électriques et/ou magnétiques.
4.1. Analyseur Quadripolaire (Q)

- Principe : Quatre tiges parallèles (quadrupoles) disposées symétriquement. Application de tensions RF (radiofréquence) et DC (courant continu) sur les quadrupoles. Les ions oscillent dans l’espace entre les quadrupoles. Seuls les ions avec un rapport m/z spécifique ont une trajectoire stable et atteignent le détecteur.
- Modes de Balayage :
- Balayage en m/z (Scan) : Variation continue des tensions RF et DC pour balayer une gamme de m/z. Obtention d’un spectre de masse complet.
- Surveillance d’Ions Sélectés (SIM) : Fixation des tensions RF et DC pour sélectionner et détecter un ou quelques ions spécifiques. Augmentation de la sensibilité pour la quantification.
- Caractéristiques :
- Simple, robuste et économique.
- Résolution modérée.
- Vitesse de balayage rapide.
- Largement utilisé dans les instruments GC-MS et LC-MS.
4.2. Analyseur Temps de Vol (TOF ou Time-of-Flight)

- Principe : Les ions sont accélérés par un champ électrique avec une énergie cinétique identique, puis pénètrent dans un tube de vol sans champ. Les ions plus légers (plus petit m/z) arrivent au détecteur plus rapidement que les ions plus lourds.
- Énergie cinétique (Ec) des ions :
Ec = \frac{1}{2}mv^2 = z eV
où :mest la masse de l’ion.vest la vitesse de l’ion.zest la charge de l’ion.eest la charge élémentaire.Vest le potentiel d’accélération.
- Temps de vol (t) :
t = L \sqrt{\frac{m}{2zeV}}
oùLest la longueur du tube de vol.
- Énergie cinétique (Ec) des ions :
- Caractéristiques :
- Haute résolution et haute précision en masse.
- Gamme de m/z théoriquement illimitée.
- Sensibilité élevée.
- Adapté à l’analyse de grosses molécules (biomolécules, polymères).
- Utilisé en MALDI-TOF et LC-TOF.
- Réflectron TOF : Amélioration de la résolution en compensant la dispersion de l’énergie cinétique initiale des ions.
4.3. Piège Ionique (Ion Trap)

- Principe : Les ions sont piégés dans un espace tridimensionnel (piège ionique 3D) ou bidimensionnel (piège ionique linéaire 2D) en utilisant des champs électriques RF et DC.
- Balayage en m/z : En variant les tensions RF et DC, les ions de différents m/z sont éjectés séquentiellement du piège et détectés.
- MSn (Spectrométrie de Masse en Tandem Multiple) : Possibilité d’isoler un ion précurseur, de le fragmenter par collision (CID, Collision-Induced Dissociation) à l’intérieur du piège, puis d’analyser les ions fragments. Répétition possible (MS3, MS4, … MSn) pour obtenir des informations structurales détaillées.
- Caractéristiques :
- Résolution et sensibilité modérées.
- Capacité MSn : Très utile pour l’élucidation structurale et l’analyse de mélanges complexes.
- Compact et relativement économique.
- Utilisé en LC-MS et GC-MS.
4.4. Analyseur Orbitrap
- Principe : Les ions sont injectés dans un champ électrostatique en forme de fuseau et suivent une trajectoire orbitale autour d’une électrode centrale. La fréquence d’oscillation axiale des ions est mesurée et utilisée pour déterminer leur m/z avec une très haute précision.
- Caractéristiques :
- Très haute résolution (jusqu’à > 500 000 FWHM) et très haute précision en masse (quelques ppm ou sub-ppm).
- Sensibilité élevée.
- Adapté à l’analyse de mélanges complexes et à l’identification de composés inconnus.
- Utilisé en LC-MS haute résolution pour la protéomique, la métabolomique, la pharmacocinétique, etc.
- Plus coûteux que les analyseurs quadripolaires ou pièges ioniques.
4.5. Analyseur Secteur Magnétique et Secteur Électrique (Double Focalisation)
- Principe : Combinaison d’un secteur magnétique (séparation des ions en fonction de leur quantité de mouvement) et d’un secteur électrique (focalisation de l’énergie cinétique des ions).
- Caractéristiques :
- Haute résolution et haute précision en masse.
- Historiquement important, moins courant dans les instruments modernes.
- Robustes et fiables.
- Utilisés pour des applications spécifiques (analyse isotopique, géochimie).
V. Détecteurs en Spectrométrie de Masse
Les détecteurs convertissent le flux d’ions séparés en un signal électrique mesurable.
5.1. Multiplicateur d’Électrons (Electron Multiplier)
- Principe : Les ions impactent une dynode (surface conductrice), ce qui provoque l’émission d’électrons secondaires. Ces électrons secondaires sont accélérés vers une dynode suivante, et le processus est répété en cascade, amplifiant le signal.
- Types : Multiplicateur d’électrons discret (dynodes séparées) ou multiplicateur d’électrons continu (dynode continue en forme de corne ou de canal).
- Caractéristiques :
- Sensibilité élevée.
- Amplification du signal.
- Rapide.
- Détecteur le plus couramment utilisé en SM.
5.2. Coupe de Faraday (Faraday Cup)
- Principe : Les ions impactent une électrode métallique (coupe de Faraday), et le courant ionique est directement mesuré.
- Caractéristiques :
- Simple et robuste.
- Quantitatif et précis.
- Moins sensible que le multiplicateur d’électrons.
- Utilisé pour les mesures de flux ioniques importants.
VI. Applications en Pharmacie
La spectrométrie de masse est un outil incontournable dans de nombreux domaines pharmaceutiques :
6.1. Découverte et Développement de Médicaments
- Identification et Caractérisation de Nouveaux Composés : Détermination de la structure, de la masse moléculaire, de la pureté de nouvelles entités chimiques (NCE) issues de la synthèse ou de produits naturels.
- Métabolomique et Criblage à Haut Débit : Analyse rapide et à haut débit de métabolites pour identifier des cibles médicamenteuses ou des biomarqueurs.
- Caractérisation de Biothérapeutiques : Analyse de protéines thérapeutiques (anticorps monoclonaux, protéines recombinantes), de peptides, d’oligonucléotides pour vérifier leur séquence, leur intégrité, leurs modifications post-traductionnelles.
6.2. Pharmacocinétique (PK) et Pharmacodynamique (PD)
- Dosage de Médicaments et de Métabolites dans les Fluides Biologiques : Quantification précise de médicaments (principe actif, métabolites) dans le plasma, le sérum, l’urine, les tissus pour étudier l’absorption, la distribution, le métabolisme et l’excrétion (ADME).
- Études de Bioéquivalence et de Biodisponibilité : Comparaison de la PK de différentes formulations d’un même médicament.
- Pharmacodynamique Basée sur les Biomarqueurs : Mesure de biomarqueurs (protéines, lipides, métabolites) pour évaluer l’effet pharmacologique d’un médicament.
6.3. Toxicologie et Sécurité des Médicaments
- Identification de Métabolites Toxiques et de Produits de Dégradation : Détection et caractérisation de métabolites potentiellement toxiques formés lors du métabolisme des médicaments.
- Études de Toxicocinétique : Détermination de la concentration de composés toxiques dans l’organisme au cours du temps.
- Dépistage de Drogues et de Toxiques : Analyse de fluides biologiques (urine, sang, cheveux) pour détecter la présence de drogues d’abus, de médicaments détournés ou de toxiques.
6.4. Contrôle Qualité et Assurance Qualité des Médicaments
- Analyse de la Pureté des Principes Actifs et des Excipients : Vérification de la pureté des matières premières utilisées dans la fabrication des médicaments.
- Détection et Quantification des Impuretés : Identification et dosage des impuretés organiques et inorganiques dans les médicaments, conformément aux exigences réglementaires (ICH, pharmacopées).
- Contrôle de la Stabilité des Médicaments : Suivi de la dégradation des médicaments au cours du temps et identification des produits de dégradation.
- Authentification et Contrefaçon de Médicaments : Identification rapide de médicaments contrefaits par comparaison de leur profil spectral avec celui de médicaments authentiques.
VII. Interprétation des Spectres de Masse : Exemples et Stratégies
L’interprétation des spectres de masse est cruciale pour obtenir des informations significatives.
7.1. Stratégies d’Interprétation
- Identifier l’Ion Moléculaire (si présent) :
- Rechercher le pic à m/z le plus élevé (sauf ions de matrice ou d’adduits).
- Vérifier les isotopes (M+1, M+2) pour confirmer la formule brute.
- Considérer le type d’ionisation utilisé ([M+H]+, [M-H]-, M+•).
- Identifier le Pic de Base : Pic le plus intense, souvent un fragment stable.
- Analyser les Ions Fragments :
- Rechercher des fragments caractéristiques de groupes fonctionnels connus.
- Proposer des mécanismes de fragmentation plausibles pour expliquer la formation des ions fragments.
- Utiliser des bases de données de fragmentation ou des logiciels d’interprétation.
- Utiliser les Isotopes :
- Les rapports d’abondance isotopique peuvent fournir des informations sur la composition élémentaire (nombre d’atomes de C, Cl, Br, S).
- Comparer les rapports isotopiques mesurés avec les rapports théoriques.
- Combiner avec d’autres Techniques :
- Utiliser les informations obtenues par RMN, IR, UV-Vis, etc., pour confirmer ou compléter l’interprétation du spectre de masse.
- Effectuer des expériences de SM/SM (tandem MS) pour obtenir des informations structurales plus détaillées.
- Utiliser des Bibliothèques Spectrales :
- Comparer le spectre expérimental avec des spectres de référence dans des bibliothèques spectrales (NIST, Wiley).
- Attention : les bibliothèques sont principalement basées sur l’ionisation par impact électronique (EI).
7.2. Exemples d’Interprétation
Exemple 1 : Spectre IE de l’Acétone (C3H6O)
- Ion Moléculaire (M+•) à m/z 58 : Pic faible, souvent fragmenté en IE.
- Pic de Base à m/z 43 : [CH3CO]+ (ion acétyle), perte d’un groupe méthyle (CH3).
- Fragmentation :
CH_3COCH_3^{+\bullet} \xrightarrow{-CH_3^{\bullet}} [CH_3CO]^+ (m/z \ 43)
- Fragmentation :
- Pic à m/z 15 : [CH3]+ (ion méthyle), fragmentation supplémentaire.
- Fragmentation :
[CH_3CO]^+ \xrightarrow{-CO} [CH_3]^+ (m/z \ 15)
- Fragmentation :
Exemple 2 : Spectre ESI+ de la caféine (C8H10N4O2)
- Ion Protoné [M+H]+ à m/z 195 : Pic moléculaire abondant en ESI.
- Fragmentation MS/MS (CID) : Pour obtenir des informations structurales.
- Exemple de fragment : Perte de CH3NCO (m/z 142), perte de CH3 (m/z 180), etc. (spectre MS/MS à analyser).
VIII. Spectrométrie de Masse en Tandem (MS/MS ou MS2)
La spectrométrie de masse en tandem (MS/MS) est une technique puissante pour l’analyse structurale et l’analyse de mélanges complexes.
8.1. Principe du MS/MS
- Sélection d’un Ion Précurseur (Parent Ion) : Un premier analyseur de masse (MS1) sélectionne un ion spécifique (ion précurseur) à partir du mélange ionique.
- Fragmentation de l’Ion Précurseur : L’ion précurseur sélectionné est fragmenté dans une cellule de collision (Collision Cell) par collision avec un gaz inerte (argon, azote). Le processus de fragmentation est appelé CID (Collision-Induced Dissociation).
- Analyse des Ions Fragments (Ions Filles ou Daughter Ions) : Un deuxième analyseur de masse (MS2) analyse les ions fragments (ions filles) produits lors de la fragmentation.
- Spectre MS/MS : Le spectre MS/MS obtenu représente l’abondance des ions fragments en fonction de leur m/z. Il fournit des informations structurales spécifiques sur l’ion précurseur.
8.2. Types de Spectromètres MS/MS
- Triple Quadruple (QqQ) : MS1 = Quadrupole, Cellule de Collision = Quadrupole, MS2 = Quadrupole. Très utilisé pour la quantification ciblée (SRM/MRM).
- Quadrupole-Temps de Vol (Q-TOF) : MS1 = Quadrupole, Cellule de Collision = Quadrupole, MS2 = TOF. Haute résolution et précision en masse pour les ions fragments.
- Piège Ionique (Ion Trap) : MS1 = Piège Ionique, Cellule de Collision = Piège Ionique (fragmentation dans le temps), MS2 = Piège Ionique. MSn possible.
- Orbitrap Hybride (Exemple : Q Exactive) : Combinaison d’un Quadrupole (pour la sélection des précurseurs) et d’un Orbitrap (pour l’analyse des fragments à haute résolution).
8.3. Applications du MS/MS
- Élucidation Structurale : Détermination de la structure de molécules inconnues en analysant les ions fragments et leurs mécanismes de formation.
- Analyse de Mélanges Complexes : Analyse sélective d’un composé d’intérêt dans un mélange complexe en sélectionnant un ion précurseur spécifique.
- Quantification Ciblée (SRM/MRM) : Quantification très sensible et spécifique de composés connus en mode Surveillance de Réactions Sélectées (SRM) ou Surveillance de Réactions Multiples (MRM) en utilisant des transitions précurseur → fragment uniques pour chaque analyte. Technique de choix en pharmacocinétique et en bioanalyse.
- Protéomique et Peptidomique : Identification et quantification de protéines et de peptides par analyse MS/MS de peptides issus de la digestion enzymatique de protéines.
IX. Spectrométrie de Masse Quantitative
La spectrométrie de masse est une technique quantitative très précise et sensible.
9.1. Principes de la Quantification en SM
- Standard Interne (SI) : Utilisation d’un composé analogue structural de l’analyte, mais isotope-marqué (deutérium, 13C, 15N). Le SI est ajouté en quantité connue à tous les échantillons et standards.
- Courbe d’Étalonnage : Préparation d’une série de standards de calibration contenant des concentrations connues de l’analyte et une quantité constante de SI. Analyse des standards par SM et construction d’une courbe d’étalonnage : rapport des aires (analyte/SI) en fonction de la concentration de l’analyte.
- Quantification des Échantillons Inconnus : Analyse des échantillons inconnus contenant le SI. Détermination de la concentration de l’analyte en utilisant la courbe d’étalonnage.
- Surveillance de Réactions Sélectées (SRM/MRM) : Utilisation du mode SRM/MRM en MS/MS pour une quantification très sensible et spécifique. Sélection d’une transition précurseur → fragment unique pour l’analyte et le SI.
9.2. Avantages de la Quantification par SM
- Haute Sensibilité : Limites de détection et de quantification très basses (pg/mL, fg/mL).
- Haute Spécificité : La sélection du m/z et l’utilisation du MS/MS permettent une quantification très sélective, même dans des matrices complexes.
- Large Gamme Dynamique : Possibilité de quantifier sur une large plage de concentrations.
- Multiplexage : Possibilité de quantifier plusieurs analytes simultanément dans le même échantillon (multiplexage SRM/MRM).
- Robustesse et Fiabilité : Technique quantitative mature et largement validée.
X. Conclusion
La spectrométrie de masse est une technique analytique incontournable en pharmacie, offrant des capacités uniques pour l’identification, la quantification et la caractérisation des molécules. Sa polyvalence, sa sensibilité et sa spécificité en font un outil essentiel pour la recherche et le développement de médicaments, la pharmacocinétique, la toxicologie, le contrôle qualité et de nombreux autres domaines pharmaceutiques. Une compréhension solide des principes fondamentaux, de l’instrumentation et des applications de la SM est essentielle pour tout pharmacien moderne.
XI. Questions de Révision
- Expliquez le principe de base de la spectrométrie de masse.
- Décrivez les principaux composants d’un spectromètre de masse et leur rôle.
- Comparez et contrastez les techniques d’ionisation IE, CI, ESI et MALDI en termes de principe, d’applications et de types d’analytes adaptés.
- Décrivez le principe de fonctionnement des analyseurs de masse quadripolaire, TOF et piège ionique.
- Quelles sont les applications de la spectrométrie de masse en pharmacie, et donnez des exemples spécifiques pour chaque application.
- Expliquez le principe de la spectrométrie de masse en tandem (MS/MS) et ses avantages.
- Comment la spectrométrie de masse est-elle utilisée pour la quantification en pharmacie, et quels sont les avantages de cette approche ?
- Interprétez un spectre de masse simple (par exemple, acétone ou éthanol) en identifiant l’ion moléculaire et les principaux ions fragments.
XII. Ressources Additionnelles
- Livres de Spectrométrie de Masse :
- « Mass Spectrometry: A Textbook » par Jürgen H. Gross
- « Biochemical and Biological Applications of Mass Spectrometry » par Robert Brown et Catherine N. Fenselau
- « Mass Spectrometry Basics » par Christopher G. Herbert et Joshua D. Wand
- Articles de Revue et Publications Scientifiques : Consulter des revues spécialisées en spectrométrie de masse et en chimie analytique (Journal of the American Society for Mass Spectrometry, Rapid Communications in Mass Spectrometry, Analytical Chemistry).
- Sites Web et Ressources en Ligne :
- American Society for Mass Spectrometry (ASMS) : https://www.asms.org/
- Mass Spectrometry Society : https://www.massspec.org/
- Base de données spectrales NIST WebBook : https://webbook.nist.gov/chemistry/ms-ser.html
Share this content:
Table des matières
