5) On dose par émission de flamme du Na et du K d’une solution de perfusion intraveineuse contenant du KCl et NaCl. 0,5092 g de NaCl et 0,1691 g de KCl sont pesés, transférés et amenés à un volume de 1L avec de \(H_2O\) l’eau distillée. Ensuite 20 ml de cette solution sont transférés dans une fiole jaugée de 100ml complété à 100ml par \( H_2O \). Cette solution est utilisée pour réaliser une courbe de calibration de la façon suivante : 5 - 10 - 15 - 20 - 25 ml sont transférés dans des fioles jaugées de 100ml puis complétés par H2O (solution A,B,C,D,E). D’autre part 5 ml de la solution pour perfusion sont amenés à un volume de 250 ml avec de l'eau distillée, puis 10 ml de cette solution sont dilués 10 fois avant d’être analysés par émission de flamme (solution X).
Le spectrophotomètre est utilisé avec un filtre pour doser Na puis avec un autre pour doser K des standards et l’échantillon. L’eau distillée sert de blanc.
Les valeurs lues au spectrophotomètre sont :
\[ \renewcommand{\arraystretch}{1.3} \begin{array}{|l|l|l|} \hline Solutions &Na^+ &K^+ \\ \hline Blanc &0 & 0 \\ \hline Solution A &20,7 &22,4 \\ \hline Solution B & 41 &41,2 \\ \hline Solution C &60,6 & 61,2 \\ \hline Solution D & 80,3 & 80,3 \\ \hline Solution E &100 & 100 \\ \hline Solution X & 70,2 &70,6 \\ \hline \end{array} \]
Quelle est la concentration molaire de \( K^+ \) de la solution de perfusion ?
Données : PM(KCl) =74,55 PM(NaCl)= 58,44
Réponse incorrecte.
Ci-après la réponse.
La concentration de KCl :
\[ \begin{align*} [KCl]&= \dfrac{masse}{Volume}= \dfrac{0,5092 g}{1L} = 0,5092 g/L \\ \text{Donc la concentration de Potassium } K^+ &= \dfrac{0,5092 g/L}{58,44 g/mol} = 0,00871 mol/L \end{align*} \]
Ci-dessous les concentrations des solutions de la gamme d'étalonnage:
(Remarque : N'oubliez pas les dilutions)
\[ \begin{array}{|l|c|c|c|c|} \hline Solutions &Signal Na^+& [Na^+]mol/l &Signal K^+& [K^+]mol/l \\ \hline Blanc &0 &0&0 & 0 \\ \hline Solution A &20,7 &8,71.10^{-5} &22,4&2,27.10^{-5} \\ \hline Solution B & 41&1,74.10^{-4} &41,2 &4,54.10^{-5}\\ \hline Solution C &60,6&2,61.10^{-4} & 61,2&6,80.10^{-5} \\ \hline Solution D & 80,3 &3,49.10^{-4}& 80,3 &9,07.10^{-5}\\ \hline Solution E &100&4,36.10^{-4} & 100&1,13.10^{-4} \\ \hline Solution X & 70,2& X &70,6& Y \\ \hline \end{array} \]
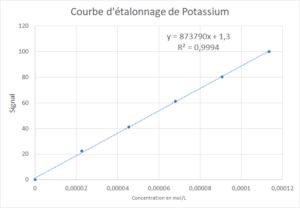
D'après l'équation de droite de la courbe d'étalonnage du Potassium:
y = 873790x + 1,3
La concentration du Potassium dans la solution X est :
\[ \begin{align*} y &= 873790 x + 1,3\\ x &= \dfrac{y-1,3}{873790}= \dfrac{70,2-1,3}{873790} = 0,079 mmol/L \end{align*} \]
(Remarque: la solution intraveineuse analysée est diluée 500 fois : 50 x 10)
Donc la concentration du Potassium dans la solution de perfusion intraveineuse est:
\[ \begin{align*} \text{Concentration en Potassium}& =0,079 mmol/L \times 500 = 39,50 mmol/L \end{align*} \]
Bon Travail.
Excellent.
La concentration de KCl :
\[ \begin{align*} [KCl]&= \dfrac{masse}{Volume}= \dfrac{0,5092 g}{1L} = 0,5092 g/L \\ \text{Donc la concentration de Potassium } K^+ &= \dfrac{0,5092 g/L}{58,44 g/mol} = 0,00871 mol/L \end{align*} \]
Ci-dessous les concentrations des solutions de la gamme d'étalonnage:
(Remarque : N'oubliez pas les dilutions)
\[ \begin{array}{|l|c|c|c|c|} \hline Solutions &Signal Na^+& [Na^+]mol/l &Signal K^+& [K^+]mol/l \\ \hline Blanc &0 &0&0 & 0 \\ \hline Solution A &20,7 &8,71.10^{-5} &22,4&2,27.10^{-5} \\ \hline Solution B & 41&1,74.10^{-4} &41,2 &4,54.10^{-5}\\ \hline Solution C &60,6&2,61.10^{-4} & 61,2&6,80.10^{-5} \\ \hline Solution D & 80,3 &3,49.10^{-4}& 80,3 &9,07.10^{-5}\\ \hline Solution E &100&4,36.10^{-4} & 100&1,13.10^{-4} \\ \hline Solution X & 70,2& X &70,6& Y \\ \hline \end{array} \]

\begin{enumerate}
\item D'après l'équation de droite de la courbe d'étalonnage du Potassium:
\begin{align*}
y = 873790x + 1,3
\end{align*}
La concentration du Potassium dans la solution X est :
\[ \begin{align*} y &= 873790 x + 1,3\\ x &= \dfrac{y-1,3}{873790}= \dfrac{70,2-1,3}{873790} = 0,079 mmol/L \end{align*} \]
(Remarque: la solution intraveineuse analysée est diluée 500 fois : 50 [/latex]\times[/latex] 10)
Donc la concentration du Potassium dans la solution de perfusion intraveineuse est:
\[ \begin{align*} \text{Concentration en Potassium}& =0,079 mmol/L \times 500 = 39,50 mmol/L \end{align*} \]
Ci-après la réponse.
La concentration de NaCl :
\[ \begin{align*} [NaCl] &=\dfrac{masse}{Volume}= \dfrac{0,5092 g}{1L} = 0,5092 g/L \\ &\text{Donc la concentration de Sodium }\\ Na^+&= \dfrac{0,5092 g/L}{58,44 g/mol} = 0,00871 mol/L \end{align*} \]