Fluorimétrie « émission de fluorescence »
Introduction
Spectroscopie d’absorption et d’émission
- Moléculaire
- Bande
- Énergie électronique
- Les molécules sont excitées puis reviennent à l’état fondamental en émettant un rayonnement lumineux
État singulet et triplet
Règle de sélection (2S+1)
- un état ou tous les électrons sont appariés = singulet
- une paire excitée forme soit un singulet ou triplet (moins énergétique que singulet).
- état singulet (S):
 électrons à spins opposés M = 2S + 1 = 1
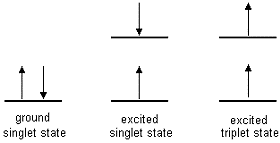
électrons à spins opposés M = 2S + 1 = 1 - état triplet (T):
 électrons à spins parallèles M = 2S + 1 = 3
électrons à spins parallèles M = 2S + 1 = 3
| Méthode | Energie d’excitation | Emission |
| Chimiluminescence | Réaction chimique | Luminescence |
| Bioluminescence | Réaction biochimique | Luminescence |
| Photoluminescence | REM | Fluorescence ou Phosphorescence |
Diagramme de JABLONSKI
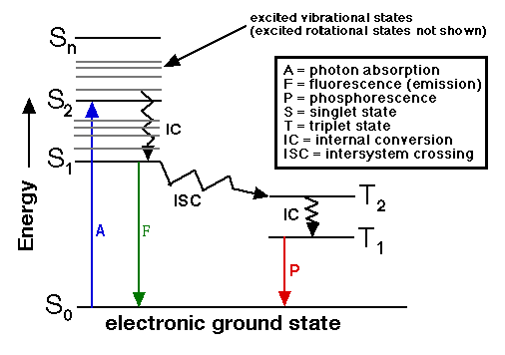
Interprétation :
Absorption d’énergie:
Origine : S0; A t° ambiante, la majorité des molécules se trouvent au niveau de vibration le plus bas (Vo) du niveau Eo : tous les e- sont appariés : la somme des spins S = 0
Absorption d’un quantum d’énergie : ![]()
Si E est suffisamment grande: peuplement des niveaux d’énergie supérieurs:
E1, E2 ![]() S1, S2 (même phénomène : UV- visible, fluorescence, phosphorescence)
S1, S2 (même phénomène : UV- visible, fluorescence, phosphorescence)
Durée de l’excitation S0 ![]() S1 ou Sn: 10-15 s
S1 ou Sn: 10-15 s
État instable ![]() relaxation
relaxation
Relaxation :
Perte d’énergie: collision avec les molécules (solvant); [/latex]\Delta[/latex] E ém < [/latex]\Delta [/latex]E abs [/latex]\Longrightarrow[/latex]bande d’émission vers grandes [/latex]\lambda[/latex]
- [/latex]\longrightarrow[/latex]S1 : 10-11 s (Sn : retour à S1 (Vo) par CI et RV (non radiatif)
- S1 (V0) [/latex]\longrightarrow[/latex]S0 fluo. : 10-8 s S1 (V0) [/latex]\longrightarrow[/latex]S0 chal. : 10-4 s
- l’e- change de spin: S = 1; 2S + 1 = 3 (état T) et subie deux types de transition:
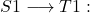 (CIS) ou (CIC). C’est une transition interdite ; donc peu probable.
(CIS) ou (CIC). C’est une transition interdite ; donc peu probable. (Em. Phos.) : qqs microsec.
(Em. Phos.) : qqs microsec.
Position et forme des spectres
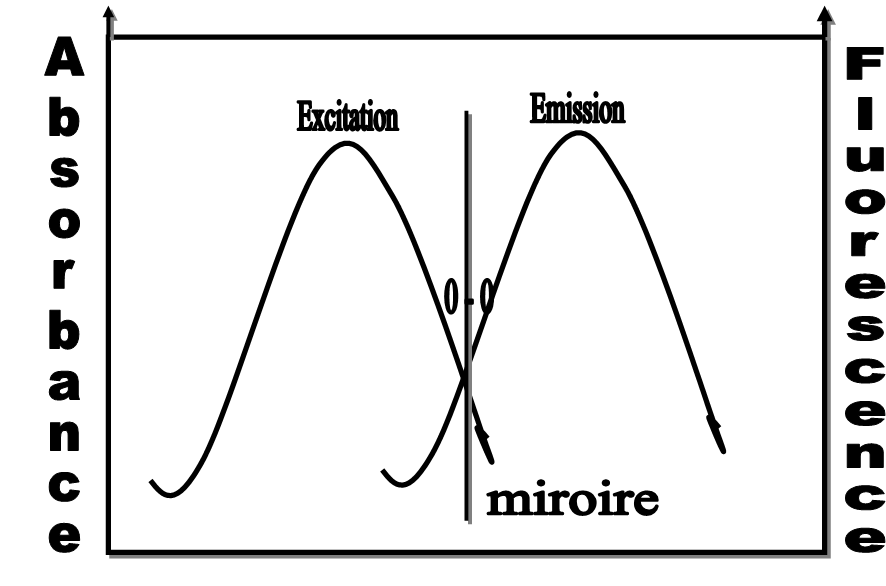
Interprétation des spectres :
L’émission de fluorescence est située à :
![]() : transition 0
: transition 0 ![]() transition (S0)V0
transition (S0)V0 ![]() (S1)V0 (abs) (S1)V0
(S1)V0 (abs) (S1)V0 ![]() (S0)V0 (ém) ( intersection spectre émission et spectre excitation)
(S0)V0 (ém) ( intersection spectre émission et spectre excitation)
![]() : Cas particulier : (loi ANTI-TOCKES)
: Cas particulier : (loi ANTI-TOCKES)
Transition : E0 (V1), (V2) ou …(Vn) ![]() E1(abs)
E1(abs)
Retour : E1 (V0) ![]() E0 (V0) : E grande à l’émission
E0 (V0) : E grande à l’émission ![]() L’émission de fluorescence est l’image dans un miroir de l’absorbance
L’émission de fluorescence est l’image dans un miroir de l’absorbance
Tracé des spectres:
- Spectre d’absorption = spectre d’excitation (Comparable au spectre UV – Visible)
- Absorption UV-visible:
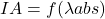
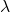 ém. fixe (Imax)
ém. fixe (Imax)
- Absorption UV-visible:
- Spectre d’émission = spectre de fluorescence
- Emission de fluorescence:
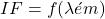
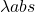 fixe (Imax)
fixe (Imax)
- Emission de fluorescence:
NB: Mesure de I au max de [/latex]\lambda[/latex]
Aspects quantitatifs de la fluorescence
Intensité de fluorescence (IF)
conditions de fluorescence
Pour qu’une molécule fluoresce, il faut une absorption dans l’UV proche ou le visible (absorption < 200 nm [/latex]\Longrightarrow[/latex] pas de fluorescence).
c à d que la différence entre les niveaux d’énergie ne soit pas trop grande.
Fluorescence et transitions:
 fluorescence
fluorescence phosphorescence plutôt que fluorescence
phosphorescence plutôt que fluorescence pas de fluorescence
pas de fluorescence
La durée de vie de l’état singulet doit être brève (10-9 s) sinon on a des phénomènes de conversion interne croisée.
Les états singulet et triplet doivent être bien séparés.
Molécules fluorescentes
- Les composés aliphatiques ne fluorescent pas.
- Les composés aromatiques fluorescent : la fluorescence augmente avec le nombre de cycles dans la molécule. Ex: naphtalène, anthracène.
- Les composés hétérocycliques ( N, O, S) ne sont pas fluorescents mais quand ils sont accolés à un noyau aromatique (composés indoliques) ils sont très fluorescents.
Mesure de l’intensité de fluorescence
L’échantillon est placé dans une cuve. On dirige sur cette cuve un rayonnement d’excitation de [/latex]\lambda[/latex] donnée
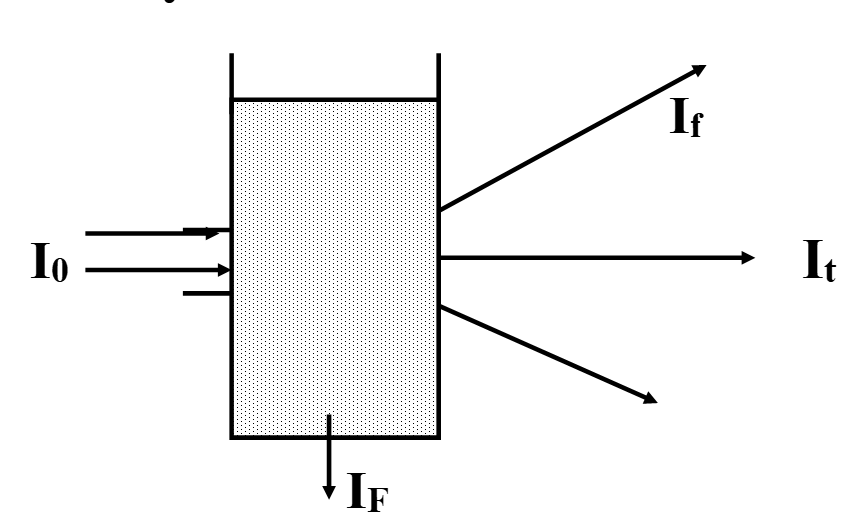
Une partie de la lumière est absorbée, une partie est transmise. En plus, on observe une émission de REM à une [/latex]\lambda[/latex]ém (fluorescence).
La mesure de IF se fait perpendiculairement au faisceau d’excitation; (IF se fait dans ttes les directions).
IF à [/latex]\lambda[/latex] ém est [/latex]\cong[/latex] à IA (absorbée) :
IF = [/latex]\phi[/latex]. IA ([/latex]\phi[/latex] = Rd quantique de fluo.)
[/latex]\phi[/latex]= nbre de photons émis/nbre de photons excités.
\begin{align}
\phi&= Kf\dfrac{(MS1)}{Ka(MS0)}\\
\phi&= Kf \dfrac{(MS1)}{(MS1)}\cdot[Kf + Kisc + KCI] \\
\phi&= \dfrac{Kf}{[Kf + Kisc + KCI]} \Rightarrow 0 <\phi<1\\
&\text{Durée de vie de l’état S1 est par définition:}\\
\tau &=\dfrac{1 }{Kf+Kisc+KCI}\\
\text{et} (MS1)_t &= (MS1)_0e^{-[Kf+Kisc+ KCI]\cdot t}
\end{align}
[/latex]\Rightarrow[/latex] Evolution de la population à l’état S1 d’une molécule en fonction de t = exponentielle décroissante
Expression de IF
[/latex]IF = \phi. IA [/latex] avec: [/latex]I_A = I_0 – I_T[/latex]
[/latex]IF = \phi (I_0 – I_T) = \phi (I_0 -I_0.e^{-\varepsilon lc}) = \phi I_0(1 – e^{-\varepsilon lc}[/latex])
Approximation:
Pour des (c) faibles, telle que :A = [/latex]\varepsilon[/latex]lC < 0.05 :
e-[/latex]\varepsilon[/latex]lc = 1 – [/latex]\varepsilon[/latex]lC
IF = [/latex]\phi[/latex] Io(1 – e-[/latex]\varepsilon[/latex]lC) = [/latex]\phi[/latex]o(1 – 1 + [/latex]\varepsilon[/latex]lC)
IF = [/latex]\phi[/latex] Io [/latex]\varepsilon[/latex]lC (relation linéaire)
Si C est grande, IF n’est plus linéaire
Facteurs modifiant l’intensité
Différents facteurs expérimentaux peuvent modifier l’intensité de fluorescence.
- lumière : nature du rayonnement utilisé
 (exc)
(exc)  est variable en fonction de
est variable en fonction de 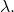
Choisir la valeur [/latex]\lambda[/latex]max d’excitation qui correspond à IF maximum.
IF augmente avec Io; la sensibilité augmente
NB : photo-décomposition : si Io élevée [/latex]\Rightarrow[/latex] risque de casser les molécules , pas de fluorescence. (Ex :cas des nucléotides).
- mesurer IF à
 ém max
ém max - l ( parcours optique) : cuve de 1 cm pour augmenter la fluorescence.
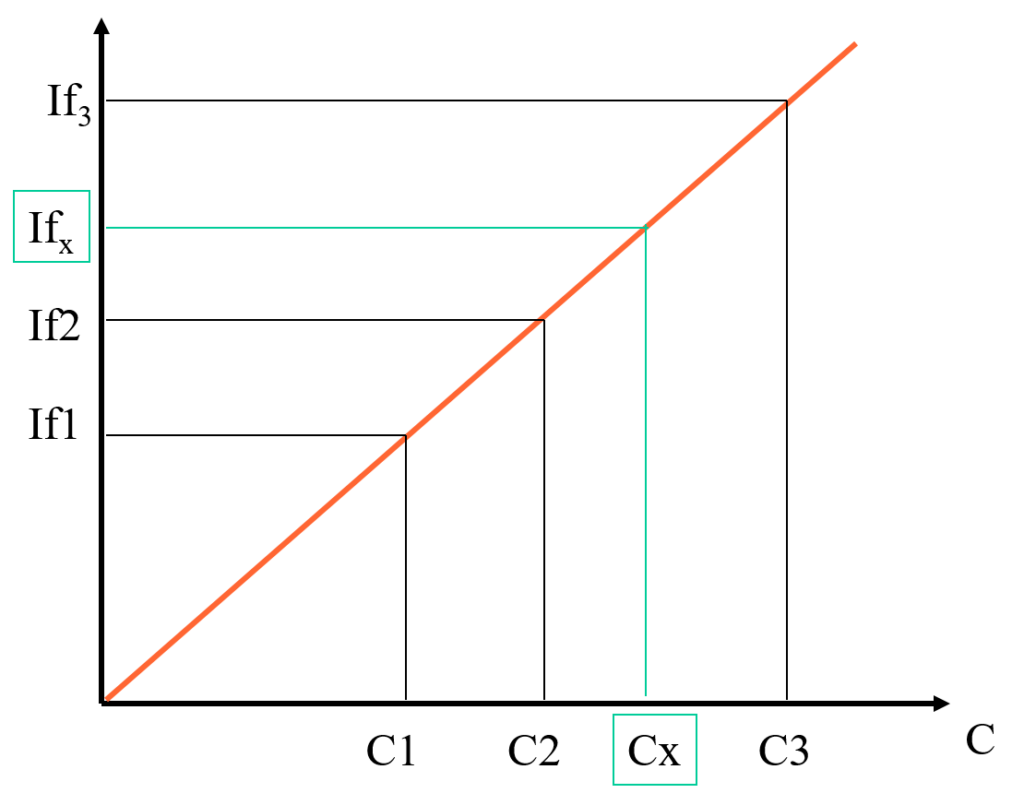
IF = f(C)
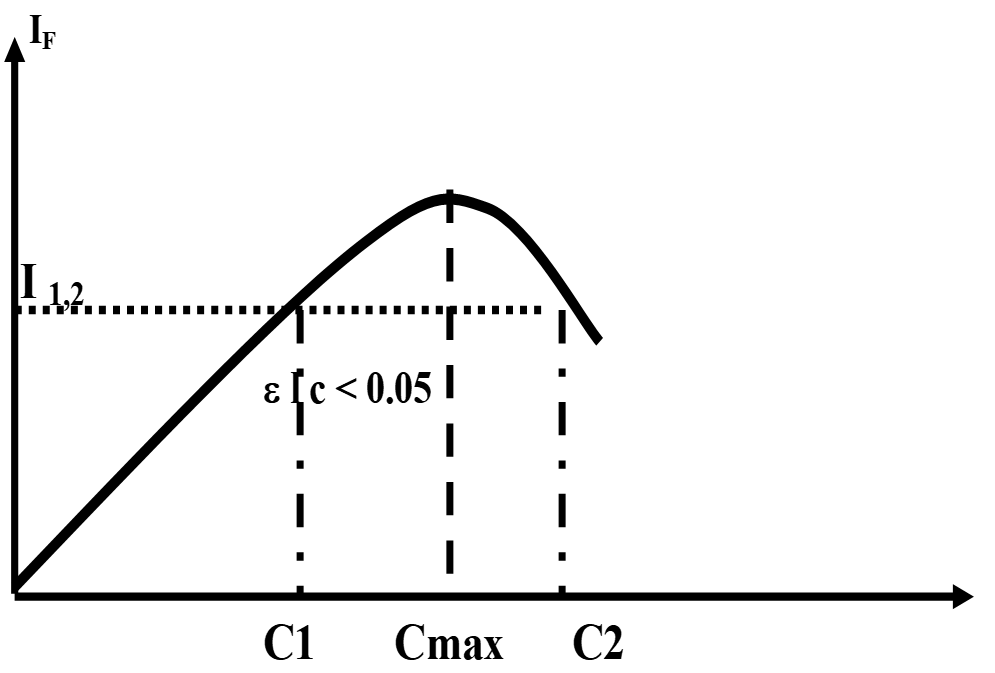
(1): deux (C)possibles pour un IF
(2): = linéaire If prop. à (C)
- Travailler en parallèle sur 1 solution diluée afin de s’assurer du résultat
Effet de la concentration Sur If
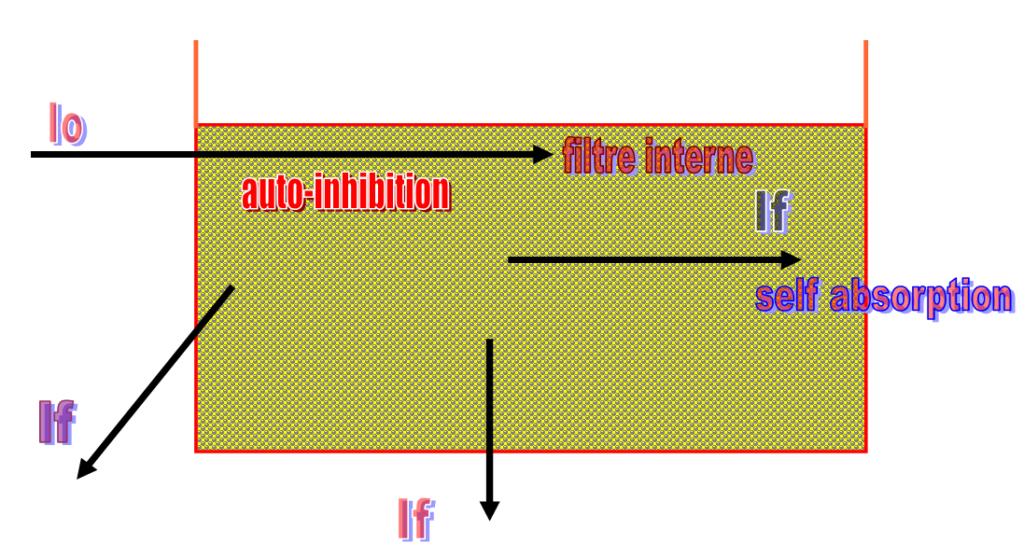
perte de linéarité pour des fortes conc. s’explique par :
- Auto inhibition : due à la collision entre les molécules d’où perte de E sous forme thermique
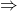 pas de fuo.
pas de fuo. - Effet de filtre interne: dû à l’abs. de I0 en totalité par les 1ères couches des molécules dans la cuve : les 1ères couches de la solution fluorescent (absorbent la totalité de la lumière), alors que les molécules des couches profondes ne seront pas excitées.
- Self absorption: la lumière de fluorescence est réabsorbée par les molécules environnantes
Fluorescence et structure :
Fluo naturelle: quinine, tétracycline,vit. B,E)
- Molécules insaturées (aromatiques, c=c)
- Pas de relation entre structure et fluo.
- Structure cyclique beaucoup de chance d’être fluorescente; IF augmente avec la rigidité et le nombre de cycle (pyridine, quinoléine)
Fluo non naturelle:
- Réaction hétérocyclisation (N,O) condensation d’othodiamine
- Réaction dérivation (greffer un réactif): OPA pour
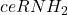 ;RSH Coumarine pour acide;
;RSH Coumarine pour acide;
Influence des substituants
S’ils [/latex]\nearrow[/latex] la mobilité des e- [/latex]\pi[/latex], If [/latex]\nearrow[/latex] et inversement.
| Radical | IF | |
| Alcoyle | 0 | |
| – OH, – OR | + | |
| – COOH, – SH | + | |
| – NH2 , RNH | + | |
| – NO2 , – NO | – | Inhibition |
| – CN | 0 |
Facteurs externes
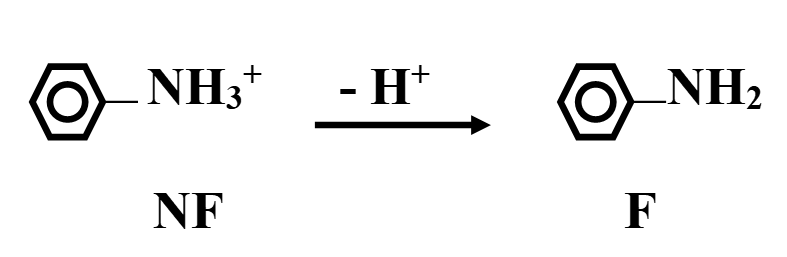
pH:
pour les molécules ayant un caractère acido-basique, il y a modification de la structure selon le pH ce qui entraîne une modification de la fluorescence.
Quenching : inhibition de Fluorescence
Diminution de IF sous l’effet des collisions entre les particules fluorescentes et les espèces présentes dans le milieu de mesure.
- Quenching statique: collisions à l’état S0.
- Quenching dynamique: collisions à l’état Sn
- Quenching sans collision (par couplage)
quenching par transfert d’énergie:
Ex. avec collision:
(1) ![]()
Ex. sans collision:
*** QuickLaTeX cannot compile formula:
\begin{align*}A^{\ast} + B \longrightarrow A + B^{\ast}(nF) &\longrightarrow + h\nu chal \Rightarrow (\text{inhibition totale}) \\ Fluo. type éosine:& \\ S1 + kT°\longrightarrow T1; T1 &\longrightarrow S1; S1 \longrightarrow S0 + h\nu F (\text{fluo retardée}) \\ Fluo. type pyrène:& \\ 2T1 \longrightarrow S1+ S0 + h \searrow P \\ S1 &\longrightarrow S0 + h \nu F ( \text{mélange de Fluo. Et Phos.})\\ &\text{quenching par transfert d'e-} Fe^{2+} : ( \text{réduction du BM^{+}}) \\Fe^{2+} + BM^{+} (F) &\longrightarrow Fe^{3+} + BM^{}(n F)) \end{align*}
*** Error message:
Please use \mathaccent for accents in math mode.
leading text: ...htarrow Fe^{3+} + BM^{}(n F)) \end{align*}
Please use \mathaccent for accents in math mode.
leading text: ...htarrow Fe^{3+} + BM^{}(n F)) \end{align*}
Missing $ inserted.
leading text: ...htarrow Fe^{3+} + BM^{}(n F)) \end{align*}
Extra }, or forgotten $.
leading text: ...htarrow Fe^{3+} + BM^{}(n F)) \end{align*}
Extra }, or forgotten $.
leading text: ...htarrow Fe^{3+} + BM^{}(n F)) \end{align*}
Extra }, or forgotten $.
leading text: ...htarrow Fe^{3+} + BM^{}(n F)) \end{align*}
Missing $ inserted.
leading text: ...htarrow Fe^{3+} + BM^{}(n F)) \end{align*}
Extra }, or forgotten $.
leading text: ...htarrow Fe^{3+} + BM^{}(n F)) \end{align*}
Extra }, or forgotten $.
leading text: ...htarrow Fe^{3+} + BM^{}(n F)) \end{align*}
Solvant :
pas de relation entre nature Sv et Fluo. [/latex]\longrightarrow[/latex] tester plusieurs Sv: ex Sulfanilamides dans différents Sv:
(eau: 100; EtOH: 107; acétone: 0; isobutane: 33)
Température :
F T ([/latex]\Delta[/latex]H au lieu de F)
1°C F de ![]() à T°sup à 40°C
à T°sup à 40°C ![]() Mesure à t0
Mesure à t0
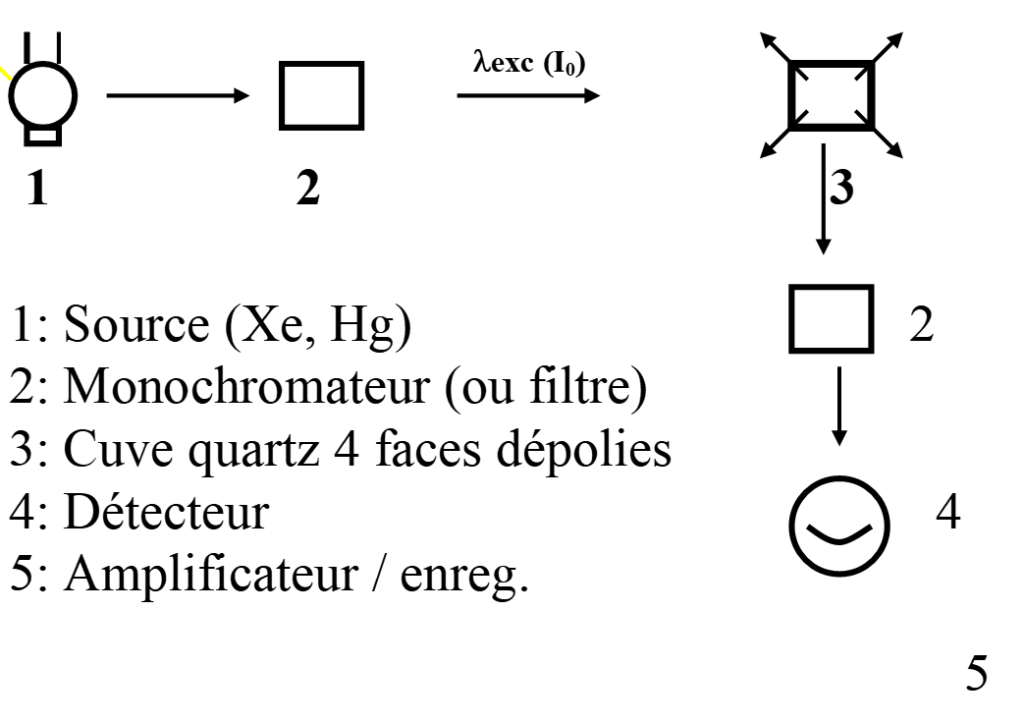
MESURES: – Instrumentation
Schéma de principe
Conditions de mesure et erreurs
- Mesurer IF à 90°. Pour recueillir IF, on met un monochromateur à
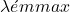 de la molécule.
de la molécule. - Échantillonnage:
- travailler sur des solutions diluées dans différents solvants.
- utiliser des produits purs et verrerie propre pour éviter la fluo parasite. (attention aux lessives…).
Dosage: mesure relative; droite d’étalonnage
Applications
Analyse qualitative
Sélective; 1seul [/latex]\lambda[/latex]max ém et 1 seul ![]() max exc./Sv; complémentaire à l’U.V-Vis.
max exc./Sv; complémentaire à l’U.V-Vis.
Analyse quantitative
- Dosage des molécules fluorescentes ou rendues fluo.(médicaments, PA…)
- Méthode sensible (plus que UV-Vis car basée sur 2
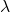 max ).
max ). - Mesure de faibles concentrations
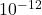
Exemple de dosage:
- biologie : cortisol, vitamine B2, B6.
- médicaments : sulfate de quinine, tétracycline
- dosage immuno-chimique : marquage fluorescent.
\begin{align}Ac + Ag^\circ &\rightleftharpoons Ac – Ag^\circ\\ Ac + Ag^\ast &\rightleftharpoons (Ac – Ag)^\ast \end{align}
Quand ![]()
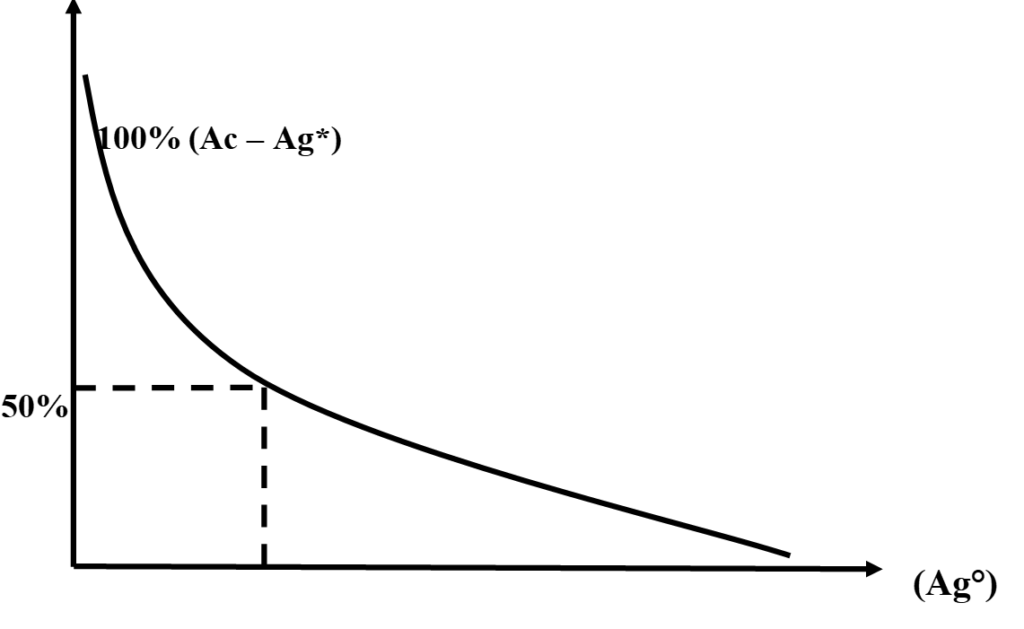
NB : éviter la fluorescence parasite
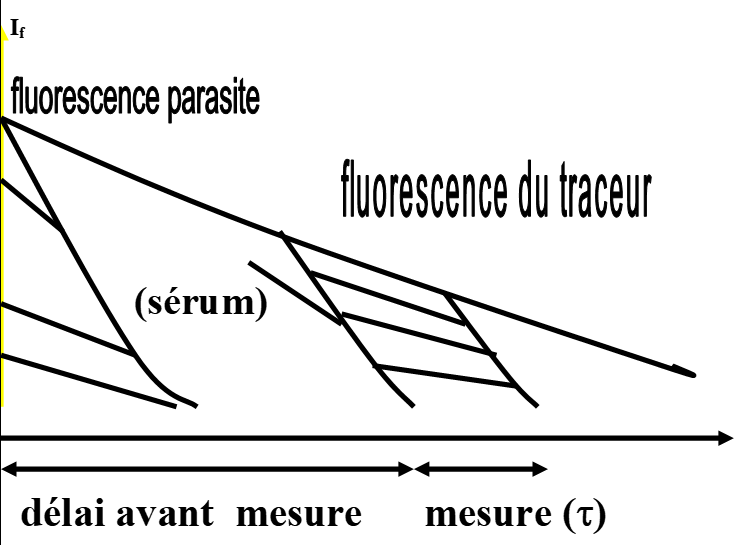
Fluorescence résolue dans le temps: ex
Sérum fluo.[/latex]\lambda[/latex] exc : 340 nm;
Traceur (durée de vie élevée) [/latex]\lambda[/latex]exc:320 nm [/latex]\lambda[/latex]em: 618 nm; [/latex]\tau[/latex] = 200 à 500 [/latex]\mu s[/latex]
Il faut un marqueur de fluo differente ex: cryptate d’europium
Couplage: CCM, HPLC (Rx dérivation en pré ou post-colonne, rapide) pas d’automatisation.
Polarisation de fluo: appliquée à des fins analytiques ( polym; immuno.)
-obtention par prisme de Nicol [/latex]\longrightarrow[/latex] exc. et émis. Une seule et même direction
-but: différencier des molécules marquées et non marquées:
si petites molécules (redépolarisation); si grosses molécules (pas de redépolaristion); d’où signal différent
Quiz
[WpProQuiz 4]
Share this content:
Table des matières